Коррозия. Коррозия: ее опасности и способы предотвратить
Основной материал для изучения темы:
§ 13, стр. 81.
Габриелян, О. С.
Химия. 9 класс: Дрофа, 2013.
Дополнительный материал по теме «Коррозия металлов»
Корро́зия , ржавление, ржа - это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево илиполимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример - кислородная коррозия железа в воде:
Гидроксид железа Fe(OH) 3 и является тем, что называют ржавчиной.
В повседневной жизни для сплавов железа (сталей) чаще используют термин «ржавление». Менее известны случаи коррозииполимеров. Применительно к ним существует понятие «старение», аналогичное термину «коррозия» для металлов. Например, старение резины из-за взаимодействия с кислородом воздуха или разрушение некоторых пластиков под воздействием атмосферных осадков, а также биологическая коррозия. Скорость коррозии, как и всякой химической реакции, очень сильно зависит от температуры. Повышение температуры на 100 градусов может увеличить скорость коррозии на несколько порядков.
Классификация видов коррозии
Коррозионные процессы отличаются широким распространением и разнообразием условий и сред, в которых они протекают. Поэтому пока нет единой и всеобъемлющей классификации встречающихся случаев коррозии.
По типу агрессивных сред, в которых протекает процесс разрушения, коррозия может быть следующих видов:
газовая коррозия;
атмосферная коррозия;
коррозия в неэлектролитах;
коррозия в электролитах;
подземная коррозия;
биокоррозия;
коррозия под воздействием блуждающих токов.
По условиям протекания коррозионного процесса различаются следующие виды:
контактная коррозия;
щелевая коррозия;
коррозия при неполном погружении;
коррозия при полном погружении;
коррозия при переменном погружении;
коррозия при трении;
межкристаллитная коррозия;
коррозия под напряжением.
По характеру разрушения:
равномерная;
неравномерная;
избирательная;
язвенная;
точечная;
сквозная;
межкристаллитная (расслаивающая в деформированных заготовках и ножевая в сварных соединениях).
сплошная коррозия, охватывающая всю поверхность:
локальная (местная) коррозия, охватывающая отдельные участки:
Главная классификация производится по механизму протекания процесса. Различают два вида:
химическую коррозию;
электрохимическую коррозию.
Коррозия неметаллических материалов
По мере ужесточения условий эксплуатации (повышение температуры, механических напряжений, агрессивности среды и др.) и неметаллические материалы подвержены действию среды. В связи с чем термин «коррозия» стал применяться и по отношению к этим материалам, например «коррозия бетонов и железобетонов», «коррозия пластмасс и резин». При этом имеется в виду их разрушение и потеря эксплуатационных свойств в результате химического или физико-химического взаимодействия с окружающей средой. Но следует учитывать, что механизмы и кинетика процессов для неметаллов и металлов будут разными.
Коррозия металлов
 Ржавчина,
самый распространённый вид коррозии.
Ржавчина,
самый распространённый вид коррозии.

Коррозия металла.
Коррозия металлов - разрушение металлов вследствие химического или электрохимического взаимодействия их с коррозионной средой. Для процесса коррозии следует применять термин «коррозионный процесс», а для результата процесса - «коррозионное разрушение». Образование гальванических пар с пользой применяют для создания батарей и аккумуляторов. С другой стороны, образование такой пары приводит к неблагоприятному процессу, жертвой которого становится целый ряд металлов, - коррозии. Под коррозией понимают происходящее на поверхности электрохимическое или химическое разрушение металлического материала. Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии. Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Соответственно, различают химическую и электрохимическую коррозию металлов.
Типы коррозии
Различают 4 основных вида коррозии: электрохимическая коррозия, водородная, кислородная коррозия и химическая.
Электрохимическая коррозия
Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. Не следует путать с электрохимической коррозией коррозию однородного материала, например, ржавление железа или т. п. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды - либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот, или т. п., электропроводность её повышается, и скорость процесса увеличивается.
Коррозионный элемент
При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO 2 , образуется гальванический элемент, так называемый коррозионный элемент. Он представляет собой не что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с более низким окислительно-восстановительным потенциалом; второй электрод в паре, как правило, не корродирует. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами. Так, совсем небольшого количества примеси на поверхности металла с большим редокспотенциалом уже достаточно для возникновения коррозионного элемента. Особо подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклёпки.
Если растворяющийся электрод коррозионно-стоек, процесс коррозии замедляется. На этом основана, например, защита железных изделий от коррозии путём оцинковки - цинк имеет более отрицательный потенциал, чем железо, поэтому в такой паре железо восстанавливается, а цинк должен корродировать. Однако в связи с образованием на поверхности цинка оксидной плёнки процесс коррозии сильно замедляется.
Примером крупномасштабной электрохимической коррозии может служить происшествие, случившееся в декабре 1967 года с норвежским рудовозом «Анатина» (англ. Anatina ), следовавшим из Кипра в Осаку. Налетевший в Тихом океане тайфун привёл к попаданию в трюмы солёной воды и образованию большойгальванической пары: медного концентрата со стальным корпусом судна, который вскоре размягчился, и судно подало сигнал бедствия. Экипаж был спасён подоспевшим немецким судном, а сама «Анатина» еле-еле добралась до порта.
Водородная и кислородная коррозия
Если происходит восстановление ионов H 3 O + или молекул воды H 2 O, говорят о водородной коррозии или коррозии с водородной деполяризацией. Восстановление ионов происходит по следующей схеме:
2H 3 O + + 2e − → 2H 2 O + H 2
2H 2 O + 2e − → 2OH − + H 2
Если водород не выделяется, что часто происходит в нейтральной или сильно щелочной среде, происходит восстановление кислорода и здесь говорят о кислородной коррозии или коррозии с кислородной деполяризацией:
O 2 + 2H 2 O + 4e − → 4OH −
Коррозионный элемент может образовываться не только при соприкосновении двух различных металлов. Коррозионный элемент образуется и в случае одного металла, если, например, структура поверхности неоднородна.
Химическая коррозия
Электрокоррозия полотенцесушителя
Химическая коррозия - взаимодействие поверхности металла с коррозионно-активной средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. В этом случае взаимодействия окисления металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом:
При электрохимической коррозии ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала металла (например, ржавление стали в морской воде).
Виды коррозии
Газовая коррозия
Атмосферная коррозия
Коррозия при неполном погружении
Коррозия по ватерлинии
Коррозия при полном погружении
Коррозия при переменном погружении
Подземная коррозия
Биокоррозия
Коррозия внешним током
Коррозия блуждающим током
Контактная коррозия
Коррозия при трении
Фреттинг-коррозия
Сплошная коррозия
Равномерная коррозия
Неравномерная коррозия
Местная коррозия
Подповерхностная коррозия
Точечная коррозия
Коррозия пятнами
Сквозная коррозия
Послойная коррозия
Нитевидная коррозия
Структурная коррозия
Межкристаллитная коррозия
Избирательная коррозия
Графитизация чугуна
Обесцинкование
Щелевая коррозия
Ножевая коррозия
Коррозионная язва
Коррозионное растрескивание
Коррозия под напряжением
Коррозионная усталость
Предел коррозионной усталости
Коррозионная хрупкость
Борьба с коррозией
Коррозия приводит ежегодно к миллиардным убыткам, и решение этой проблемы является важной задачей. Основной ущерб, причиняемый коррозией, заключается не в потере металла как такового, а в огромной стоимости изделий, разрушаемых коррозией. Вот почему ежегодные потери от неё в промышленно развитых странах столь велики. Истинные убытки от неё нельзя определить, оценив только прямые потери, к которым относятся стоимость разрушившейся конструкции, стоимость замены оборудования, затраты на мероприятия по защите от коррозии. Ещё больший ущерб составляют косвенные потери. Это простои оборудования при замене прокорродировавших деталей и узлов, утечка продуктов, нарушение технологических процессов.
Идеальная защита от коррозии на 80 % обеспечивается правильной подготовкой поверхности, и только на 20 % качеством используемых лакокрасочных материалов и способом их нанесения . Наиболее производительным и эффективным методом подготовки поверхности перед дальнейшей защитой субстрата являетсяабразивоструйная очистка.
Обычно выделяют три направления методов защиты от коррозии:
Конструкционный
Активный
Пассивный
Для предотвращения коррозии в качестве конструкционных материалов применяют нержавеющие стали, кортеновские стали, цветные металлы. При проектировании конструкции стараются максимально изолировать от попадания коррозионной среды, применяя клеи, герметики, резиновые прокладки.
Активные методы борьбы с коррозией направлены на изменение структуры двойного электрического слоя. Применяется наложение постоянного электрического поля с помощью источника постоянного тока, напряжение выбирается с целью повышения электродного потенциала защищаемого металла. Другой метод - использование жертвенного анода, более активного материала, который будет разрушаться, предохраняя защищаемое изделие.
В качестве защиты от коррозии может применяться нанесение какого-либо покрытия, которое препятствует образованию коррозионного элемента (пассивный метод).
Кислородная коррозия оцинкованного железа
Кислородная коррозия железа, покрытого оловом
Красочное покрытие, полимерное покрытие и эмалирование должны, прежде всего, предотвратить доступ кислорода и влаги. Часто также применяется покрытие, например, стали другими металлами, такими как цинк, олово, хром, никель. Цинковое покрытие защищает сталь даже когда покрытие частично разрушено. Цинк имеет более отрицательный потенциал и корродирует первым. Ионы Zn 2+ токсичны. При изготовлении консервных банок применяют жесть, покрытую слоем олова. В отличие от оцинкованной жести, при разрушении слоя олова корродировать, притом усиленно, начинает железо, так как олово имеет более положительный потенциал. Другая возможность защитить металл от коррозии - применение защитного электрода с большим отрицательным потенциалом, например, из цинка или магния. Для этого специально создаётся коррозионный элемент. Защищаемый металл выступает в роли катода, и этот вид защиты называют катодной защитой. Растворяемый электрод, называют, соответственно, анодом протекторной защиты. Этот метод применяют для защиты от коррозии морских судов, мостов, котельных установок, расположенных под землей труб. Для защиты корпуса судна на наружную сторону корпуса крепят цинковые пластинки.
Если сравнить потенциалы цинка и магния с железом, они имеют более отрицательные потенциалы. Но тем не менее корродируют они медленнее вследствие образования на поверхности защитной оксидной плёнки, которая защищает металл от дальнейшей коррозии. Образование такой плёнки называют пассивацией металла. У алюминия её усиливают анодным окислением (анодирование). При добавлении небольшого количества хрома в сталь на поверхности металла образуется оксидная плёнка. Содержание хрома в нержавеющей стали - более 12 процентов.
Газотермическое напыление
Для борьбы с коррозией используют также методы газотермического напыления. С помощью газотермического напыления на поверхности металла создается слой из другого металла/сплава, обладающий более высокой стойкостью к коррозии (изолирующий) или наоборот менее стойкий (протекторный). Такой слой позволяет остановить коррозию защищаемого металла. Суть метода такова: газовой струей на поверхность изделия на огромной скорости наносят частицы металлической смеси, например цинк, в результате чего образуется защитный слой толщиной от десятков до сотен микрон. Газотермическое напыление также применяется для продления жизни изношенных узлов оборудования: от восстановления рулевой рейки в автосервисе до нефтедобывающих компаний
Термодиффузионное цинковое покрытие
Для эксплуатации металлоизделий в агрессивных средах, необходима более стойкая антикоррозионная защита поверхности металлоизделий. Термодиффузионное цинковое покрытие является анодным по отношению к чёрным металлам и электрохимически защищает сталь от коррозии. Оно обладает прочным сцеплением (адгезией) с основным металлом за счет взаимной диффузии железа и цинка в поверхностных интерметаллидных фазах, поэтому не происходит отслаивания и скалывания покрытий при ударах, механических нагрузках и деформациях обработанных изделий.
Диффузионное цинкование, осуществляемое из паровой или газовой фазы при высоких температурах (375-850 °C), или с использованием разрежения (вакуума) - при температуре от 250 °C, применяется для покрытия крепёжных изделий, труб, деталей арматуры и др. конструкций. Значительно повышает стойкость стальных, чугунных изделий в средах, содержащих сероводород (в том числе против сероводородного коррозионного растрескивания), промышленной атмосфере, морской воде и др. Толщина диффузионного слоя зависит от температуры, времени, способа цинкования и может составлять 0,01-1,5 мм. Современный процесс диффузионного цинкования позволяет образовывать покрытие на резьбовых поверхностях крепёжных изделий, без затруднения их последующего свинчивания. Микротвёрдость слоя покрытия Hμ = 4000 - 5000 МПа. Диффузионное цинковое покрытие также значительно повышает жаростойкость стальных и чугунных изделий, при температуре до 700 °C. Возможно получение легированных диффузионных цинковых покрытий, применяемое для повышения их служебных характеристик.
Кадмирование
Покрытие стальных деталей кадмием производится методами, аналогичными цинкованию, но даёт более сильную защиту, особенно в морской воде. Применяется значительно реже из-за значительной токсичности кадмия и его дороговизны.
Хромирование

Коррозия ухудшает работутрубопроводов.
Экономические потери от коррозии металлов огромны. В США по последним данным NACE [ ущерб от коррозии и затраты на борьбу с ней составили 3,1 % от ВВП (276 млрд долларов). В Германии этот ущерб составил 2,8 % от ВВП. По оценкам специалистов различных стран эти потери в промышленно развитых странах составляют от 2 до 4 % валового национального продукта. При этом потери металла, включающие массу вышедших из строя металлических конструкций, изделий, оборудования, составляют от 10 до 20 % годового производства стали.

Обрушение Серебряного моста.
Ржавчина является одной из наиболее распространённых причин аварий мостов. Так как ржавчина имеет гораздо больший объём, чем исходная масса железа, её наращивание может привести к неравномерному прилеганию друг к другу конструкционных деталей. Это стало причиной разрушения моста через реку Мианус в 1983 году, когда подшипники подъёмного механизма проржавели внутри. Три водителя погибли при падении в реку. Исследования показали, что сток дороги был перекрыт и не был почищен, а сточные воды проникли в опоры моста. 15 декабря 1967 года Серебряный мост, соединяющий Поинт Плезант, штат Западная Виржиния, и Канауга, штат Огайо, неожиданно рухнул в реку Огайо. В момент обрушения 37 автомобилей двигались по мосту, и 31 из них упали вместе с мостом. Сорок шесть человек погибли, и девять серьёзно пострадали. Помимо человеческих жертв и травм, был разрушен основной транспортный путь между Западной Виржинией и Огайо. Причиной обрушения стала коррозия
Мост Кинзу в Пенсильвании был разрушен в 2003 году от торнадо прежде всего потому, что центральные основные болты проржавели, существенно снизив его устойчивость.
Домашняя работа
Сплавы
Внимание!!!
Для получения оценки «3» достаточно выполнить только первую часть работы, для получения оценки «4», необходимо выполнить без ошибок всю часть работы на «3» и также без ошибок всю часть работы на оценку «4». Для получения оценки «5» необходимо выполнить всю работу без ошибок!!!
Оценка «3»
1. Какой из металлов как простое вещество более подвержен коррозии
1) 1s 2 2s 2 2p 6 3s
2) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1
3) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2
4) 1s 2 2s 2 2p 6 3s 2 3p 1
2. Химическую коррозию вызывают
1) вода и кислород
2) оксиды углероды и серы
3) растворы солей
4) все перечисленные факторы.
3. При контакте Ni и Fe в растворе кислоты
1) железо будет растворяться
2) железо будет восстанавливаться
3) никель будет растворяться
4) будет выделяться кислород
Оценка «4»
4. Способы защиты от коррозии, при котором в рабочую среду вводят вещества, уменьшающие агрессивность среды, называют
5. Способ защиты от коррозии, при котором железный лист покрывают слоем олова
6. Наиболее активно корродирует
1) химически чистое железо
2) железо, покрытое слоем олова
3) техническое железо
4) сплав железа с титаном
Оценка «5»
7. Легирующий элемент, сообщающий стали коррозионную стойкость
8. Масса меди, выделившейся на пластинке помещенной в растворе хлорида меди (II) если в реакцию вступил цинк массой 13г
8. Масса меди, выделившейся на железной пластинке помещенной в раствор сульфата меди (II), если в реакцию вступило железо массой 11,2 г.
Определение коррозии и причины её возникновения
Коррозия – это самопроизвольный процесс разрушения металлов и сплавов в условиях природной среды.
При коррозии металлы окисляются и образуются продукты, состав которых зависит от условий среды.
Согласно современным представлениям, все основные изменения в органическом и неорганическом мире связаны с окислительно-восстановительными процессами. Окислительно-восстановительные реакции лежат в основе и коррозионных процессов.
Основной причиной коррозии является термодинамическая неустойчивость металлов и сплавов в окружающей среде. Подавляющее большинство металлов в земной коре находится в виде оксидов, сульфидов и других соединений. При получении металлов в металлургии их переводят из такого стабильного состояния в элементарную форму, которая нестабильна. При контакте металла с внешней окислительной средой появляется движущая сила, стремящаяся превратить их в стабильные соединения, подобные тем, которые находятся в рудах. Примером этого является коррозия стали. В результате этого элементарное железо превращается в окисленное двух- и трёхвалентное, которое соответствует таким минералам, как магнетит (Fe 3 O 4) или лимонит (Fe 2 O 3 ˙H 2 O).
Термодинамическая неустойчивость металлов количественно оценивается знаком и величиной изобарно-изотермического потенциала ΔG (энергии Гиббса). Самопроизвольно протекают те процессы, которые сопровождаются уменьшением энергии Гиббса, то есть для которых ΔG<0. Металлы, стоящие в ряду напряжений до водорода, имеют по сравнению с водородом более отрицательный потенциал, их окисленное состояние термодинамически более устойчиво, чем восстановленное. Для металлов, расположенных после водорода, восстановленное состояние термодинамически более устойчиво, то есть для них ΔG>0. К этой группе металлов относятся коррозионно-стойкие золото, платина, серебро и др.
Классификация коррозионных процессов. Химическая и электрохимическая коррозия
Коррозионные процессы классифицируются:
1. По механизму реакций взаимодействия металла со средой;
2. По типу коррозионной среды;
3. По характеру коррозионных разрушений на поверхности и в объёме металла;
4. По характеру механических воздействий, которым подвергается металл одновременно с действием коррозионной среды.
По первому признаку различают два вида коррозии – химическую и электрохимическую.
Химическая коррозия
Химическая коррозия протекает при взаимодействии металлов с окислителями в средах, не проводящих электрический ток. Механизм химической коррозии можно представить одностадийным процессом окисления металла, то есть взаимодействием поверхности металла с окислителем.
Химическая коррозия – это процесс самопроизвольного разрушения металла в среде окислительного газа (например, кислорода) при повышенной температуре. Скорость химической коррозии зависит от многих факторов, в первую очередь она определяется характером продуктов коррозии. При окислении на поверхности металла образуется твердая пленка оксидов. Скорость окисления определяется состоянием и защитными свойствами поверхностной плёнки. Это зависит от отношения объёмов оксидной плёнки V ок и прокорродированного металла V м, из которого она образовалась. Установлено, что для пористых плёнок, не предохраняющих металл от доступа агрессивных примесей воздуха . А для плёнок, обладающими защитными свойствами, .
Скорость химической коррозии возрастает с увеличением температуры из-за повышения коэффициента диффузии и изменения защитных свойств плёнки. Резкие изменения температуры часто вызывают быстрое разрушение защитной плёнки. Это связано с различными коэффициентами термического расширения металла и плёнки.
По условиям протекания коррозионного процесса различают газовую коррозию (протекающую в газах, парах при высокой температуре в отсутствие воды), и коррозию в жидкостях – неэлектролитах (нефть, фенол, бензин, бензол).
Электрохимическая коррозия
При электрохимической коррозии процесс взаимодействия металла с окислителем состоит из двух сопряженных реакций: анодного растворения металла и катодного восстановления окислителя. Эта коррозия может протекать в электролитах, атмосфере любого влажного газа, а также в почве.
Основным отличием электрохимической коррозии от химической является наличие влаги на поверхности металла, что приводит к контакту двух различных металлов через электролит. При этом возникают короткозамкнутые гальванопары, в результате чего появляется электрический ток. В этом случае процесс коррозии обусловлен работой гальванопары, то есть электрохимической реакцией. По этой причине электрохимическая коррозия более агрессивна по отношению к металлам, чем химическая.
Механизм электрохимической коррозии состоит в том, что происходит анодное окисление металла: M – ne = M n + и катодное восстановление окислителя (Ох) Ох+ne=Red.
Окислителями при коррозии служат молекулы кислорода, хлора, ионы Н + , Fe 3+ , NO 3 – и др. Наиболее часто при коррозии наблюдается ионизация (восстановление) кислорода в нейтральной (щелочной) среде О 2 +2Н 2 О+4е=4ОН – , в кислой среде – восстановление водорода 2Н + +2е=Н 2 .
Коррозия с участием кислорода называется коррозией с поглощением кислорода или коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозией с выделением водорода или коррозией с водородной деполяризацией.
Кроме первичных реакций, в растворе протекают вторичные реакции:
М х+ +хОН - =М(ОН) х
В результате взаимодействия металла с кислородом, как и при химической коррозии, образуется оксид металла: М(ОН) 2 =МО+Н 2 О.
Кроме анодных и катодных реакций при электрохимической коррозии происходит движение электронов в металле и ионов в электролите. Электролитами могут быть растворы солей, кислот и оснований, морская и атмосферная вода (содержащая кислород, углекислый, сернистый и др. газы). Основным отличием электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи.
Равновесные потенциалы водородного и кислородного электродов в зависимости от рН среды находят на основании уравнения Нернста:
φ 2Н + /Н2 =-0,059рН;
φ О2/ОН =1,23-0,059рН.
Коррозия металлов в различных средах
Контактная коррозия
Контактная биметаллическая коррозия является разновидностью электрохимической коррозии, вызванной контактом металлов, имеющих разные электродные потенциалы в электролите. При этом коррозия металла с более отрицательным потенциалом обычно усиливается, а разрушение металла с положительным потенциалом замедляется или полностью прекращается. При конструировании учитывают возможность контактов различных металлов.
Атмосферная коррозия
На скорость атмосферной коррозии влияет влажность и газовый состав атмосферы. Влажность,температура и степень загрязнения атмосферы влияют на качество и состав образующихся на поверхности металла плёнок. Наиболее агрессивны среды, сильно загрязненные промышленными газами (СО 2 , SO 2 , NO 2 , NH 3 , HCl), частицами солей и угольной пылью. В промышленных районах атмосферную коррозию могут интенсифицировать так называемые «кислотные дожди», основными агрессивными компонентами которых являются серные и азотные кислоты. Кислотные дожди (рН<4) легко вызывают коррозию сплавов алюминия, железа и цинка.
В зависимости от влажности атмосферы различают несколько видов атмосферной коррозии: мокрую, влажную и сухую. Мокрая атмосферная коррозия при относительной влажности до 100% наблюдается при наличии адсорбционной капиллярной или химической плёнки влаги на поверхности металла. Её толщина составляет от 0,1 мм до 1 мм. Понижение температуры интенсифицирует процесс конденсации и приводит к появлению капель влаги на поверхности металла.
Влажная коррозия возникает при влажности в атмосфере ниже 100%. Толщина плёнки влаги от 100 А 0 до 0,1 мм. При влажности воздуха менее 60% наблюдается сухая атмосферная коррозия (коррозия под действием кислорода воздуха). Процесс разрушения металла подчиняется законам, характерным для газовой коррозии.
Подземная коррозия
Коррозионные разрушения металлических конструкций в почвах и грунтах вызываются подземной коррозией. Ей подвержены трубопроводы (водные, газовые, нефтяные), опоры электроконтактной сети и др. Скорость коррозии зависит от пористости и состава почвы, величины рН, наличия микроорганизмов. Подземная коррозия протекает по механизму электрохимической коррозии. Почвенная влага играет роль электролита и процесс коррозии протекает следующими образом:
Анодная реакция Fe-2e=Fe 2+
Катодная реакция О 2 +2Н 2 О+4е=4ОН –
Реакции в почве Fe 2+ +2OH - =Fe(OH) 2 , 4Fe(OH) 2 +2H 2 O+O 2 =4Fe(OH) 3 , 2Fe(OH) 3 +(n-3)H 2 O=Fe 2 O 3 nH 2 O.
Поверхность металла в местах ограниченного доступа кислорода выполняет роль катода.
Грунтовая коррозия металлических конструкций чаще всего происходит в условиях, характерных для нейтральных сред, с участием кислорода в качестве деполяризатора. В кислых почвах может происходить коррозия с водородной деполяризацией.
Исследование коррозионной активности грунтов позволили сделать вывод о том, что наиболее коррозионно-активными являются болотистые почвы, торфяники, ил. Песок и известняк практически не коррозионно-активны. Существенное влияние на скорость коррозии металлов оказывает рН почвы. В почвах с рН меньше 6,5 коррозионная активность по отношению к стали повышается. Наибольшей коррозионной активностью обладают почвы с рН<5,5. Нейтральные почвы с рН=6,5–7,5 и слабощелочные до рН=8,5 не коррозионно-активны.
На скорость коррозии влияет также величина удельного электрического сопротивления грунта. Коррозия металлических подземных конструкций зависит от содержания в почве и грунте различных солей. Так, с увеличением содержания хлоридов, сульфатов скорость коррозии возрастает. Повышение температуры также способствует повышению скорости грунтовой коррозии металлов.
Коррозия под действием блуждающих токов
Блуждающими токами называются электрические токи, протекающие в земле при использовании её в качестве токопроводящей среды. Попадая в металлические конструкции, расположенные в грунте, они вызывают коррозию. Источниками возникновения блуждающих токов в почве являются электрифицированные железные дороги постоянного тока, трамваи, линии электропередач.
Поскольку рельсы не достаточно изолированы от земли, а почва является проводником, то часть тока уходит в землю, встречая на своём пути подземные металлические сооружения. Так как контактный провод подсоединен к положительному полюсу тяговой подстанции, а рельс – к отрицательному, то в месте выхода тока из рельса образуется анодная зона, где коррозия разрушает подошву рельса и крепежные детали. При этом, чем меньше переходное сопротивление рельс-земля, тем большая часть тока возвращается к тяговой подстанции через землю и тем интенсивнее анодная зона на рельсе. Этот вид коррозии очень опасен, так как блуждающие токи нередко распространяются на несколько десятков километров и вызывают сильные повреждения металлических конструкций.
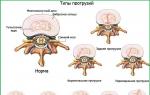
Виды коррозионных разрушений
По виду коррозионного разрушения коррозия делится на следующие виды.
1. Сплошная, или общая коррозия. Она может быть равномерной, если фронт коррозионного разрушения распределяется параллельно плоскости металла, и неравномерной, когда скорость коррозии на различных участках неодинакова.
2. Избирательная коррозия. Она характерна для сплавов и твердых растворов.
3. Локальная коррозия. Она связана с образованием и локализацией пораженных коррозией мест в виде «раковин» разной величины.
4. Питтинг - коррозия. Разрушение металла начинается в глубине, с образованием пор; часто приводит к образованию сквозных отверстий.
5. Межкристаллитная коррозия. Разрушение идет по границам металлических кристаллов.
6. Внутрикристаллическая коррозия. Наблюдается при коррозионном растрескивании под действием внешних механических нагрузок или внутренних напряжений.
Тема: Защита металлов от коррозии
Все методы защиты металлов от коррозии условно делятся на следующие группы: легирование металлов, защитные покрытия, электрохимическая защита, изменение свойств коррозионной среды, рациональное конструирование изделий.
Легирование металлов
Это эффективный метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию металла. В качестве таких компонентов применяют хром, никель, вольфрам и другие металлы. Широкое применение нашло легирование для защиты от газовой коррозии. Введение некоторых добавок в стали (титана, меди, хрома и никеля) приводит к тому, что при коррозии образуется плотная плёнка продуктов реакции, предохраняющая сплав от дальнейшей коррозии. При этом обеспечивается жаростойкость и жаропрочность сплавов.
Жаростойкость обычно обеспечивается легированием металлов и сплавов (например, стали хромом, алюминием и кремнием). Эти элементы при высоких температурах окисляются энергичнее, чем железо, и образуют плотные защитные плёнки оксидов, например, SiO 2 , Al 2 O 3 , Cr 2 O 3 . Хром и кремний также улучшают жаропрочность сталей. Легирование также используется с целью снижения скорости электрохимической коррозии, особенно коррозии с выделением водорода. К коррозионностойким сплавам относятся нержавеющие стали, в которых легирующими компонентами служат хром, никель и другие металлы.
Защитные покрытия
Слои, искусственно создаваемые на поверхности металлических изделий для предохранения их от коррозии, называются защитными покрытиями. Применяемые в технике покрытия подразделяются на металлические и неметаллические.
Металлические покрытия. Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, олово, хром, серебро), так и их сплавы (бронза, латунь и др.). По характеру поведения металлических покрытий при коррозии их можно разделить на анодные и катодные.
К катодным покрытиям относятся покрытия, потенциал которых в данной среде имеют большее значение, чем потенциал основного (покрываемого) металла. В качестве примеров катодных покрытий для стали можно привести медь, никель, кадмий, олово, серебро. При повреждении покрытия возникает коррозионный элемент, в котором основной материал (сталь) служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород. Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия.
Анодные покрытия имеют меньший потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинк на стали. В этом случае основной металл будет катодом коррозионного элемента, поэтому он не корродирует.
Для получения металлических защитных покрытий применяются различные способы: электрохимический (гальванические покрытия), погружение в расплавленный металл, термодиффузионный и химический.
Неметаллические защитные покрытия. Они могут быть как неорганическими, так и органическими. Защитное действие этих покрытий сводится в основном к изоляции металла от окружающей среды. В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединения хрома, фосфора и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, полимерными плёнками, резиной.
Электрохимическая защита
Электрохимическую защиту используют для предотвращения разрушения подземных трубопроводов, кабелей, корпусов судов, резервуаров, подводных лодок и т.д.
Электрохимическая защита основана на замедлении катодных и анодных реакций микрогальванических элементов. Она осуществляется присоединением к конструкции источника постоянного тока или дополнительного электрода.
Электрохимическую защиту подразделяют на катодную и анодную.
Катодная защита – наиболее распространенный вид электрохимической защиты. Её используют для борьбы с коррозией таких металлов и сплавов, как сталь, медь, латунь, алюминий в условиях не очень агрессивных сред. Она эффективна для предотвращения коррозионного растрескивания, обесцинкования латуней, питтинга сталей в почвах и морской воде. Наибольшее применение катодная защита получила для борьбы с коррозией подземных сооружений – трубопроводов, газопроводов, кабельных установок.
Катодную поляризацию можно осуществить путём присоединения защищаемой конструкции к отрицательному полюсу (катоду) внешнего источника тока или к металлу, имеющему меньший электродный потенциал. Положительный полюс подсоединяется к вспомогательному электроду, аноду. В процессе защиты анод активно разрушается и подлежит периодическому обновлению. В качестве материла анода применяют лом чугуна, стали, графита и т.п.
Защитный эффект можно оценить по формулам:
![]() ,
, ![]() .
.
Здесь z – защитный эффект, к 1 – показатель скорости коррозии металла без катодной защиты, к 2 – при катодной защите, Δm 1 – уменьшение массы металла без катодной защиты, Δm 2 – при катодной защите, i k – катодная плотность тока.
Протекторная защита. К защищаемой конструкции присоединяют более электроотрицательный металл – протектор, который, растворяясь в окружающей среде, посылает электроны и катодно поляризует конструкцию. После полного растворения протектора или потери контакта его с защищаемой конструкцией протектор необходимо возобновлять. В качестве протектора чаще всего используют сплавы магния и цинка. Алюминий применяется реже, так как он быстро покрывается очень плотной оксидной плёнкой, которая пассивирует его и ограничивает токоотдачу. Протектор работает эффективно, если его переходное сопротивление (между ним и окружающей средой) невелико. В процессе работы протектор может покрываться слоем продуктов коррозии, которые изолируют его от окружающей среды и резко увеличивают переходное сопротивление. Для борьбы с этим протектор помещают в наполнитель (смесь солей), облегчающую растворение продуктов коррозии. Действие протектора ограничивается определенным расстоянием (радиусом действия). В настоящее время протекторную защиту применяют для борьбы с коррозией металлических конструкций в морской и речной воде, грунте и других нейтральных средах. Использование протекторной защиты в кислых средах ограничивается высокой скоростью саморастворения протектора.
Анодная защита. Скорость электрохимической коррозии металла может быть уменьшена и при его анодной поляризации, если она смещает потенциал защищаемого металла в пассивную область.
Метод анодной защиты имеет относительно ограниченное применение, так как пассивация эффективна в основном в окислительных средах при отсутствии активных ионов (например, ионов хлора для железа). Кроме того, анодная защита потенциально опасна: в случае прерывания подачи тока возможно активирование металла и его интенсивное анодное растворение. поэтому анодная защита требует тщательной системы контроля. Защитная плотность тока достаточно низкое и потребление электроэнергии невелико. Другое достоинство анодной защиты – высокая рассеивающая способность, то есть возможность защиты на более удаленном от катода расстоянии и в электрически экранированных участках.
Метод анодной защиты используют для металлов и сплавов, легко пассивирующихся при анодной поляризации; в химической промышленности – для снижения скорости коррозии низкоуглеродистой стали в серной кислоте и в растворах, содержащих аммиак и нитрат аммония.
Защита от коррозии блуждающими токами
Борьба с коррозией блуждающими токами заключается в их уменьшении. Это достигается:
1) Поддержанием в хорошем состоянии контактов между рельсами;
2) Увеличением сопротивления между рельсом и землей (использование шпал, применение щебёночного балласта);
3) Электродренажной защитой. Она обеспечивается путём отвода блуждающих токов от металлического сооружения в сторону их источника. Для этого подземное металлическое сооружение через дренажное устройство соединяется с отрицательной шиной или отсасывающей линией;
4) Применением токоотводов. С этой целью анодные зоны (например, на трубопроводе) с помощью медного проводника соединяют с чугунным ломом (анодом). В результате блуждающие токи вызывают коррозию только этого лома – анода.
Ингибиторы коррозии
Уменьшить коррозию металлической аппаратуры, например, в теплообменных трубках охлаждения дизелей на тепловозах, можно введением в агрессивную среду соединений, значительно снижающих коррозионный процесс. Такой способ снижения скорости коррозии называется ингибированием, а вводимые в среду вещества ингибиторами ил замедлителями коррозии.
Итак, ингибиторы – это такие вещества, введение небольших количеств которых в коррозионную среду, упаковочные средства и во временные защитные покрытия снижает скорость коррозии и уменьшает ее вредные последствия. Защитное действие ингибиторов связано с изменением в состоянии поверхности защищаемого металла и в кинетике реакций, лежащих в основе коррозионного процесса.
Скорость коррозии благодаря введению ингибитора может быть снижена в любое желаемое число раз, а степень защиты доведена почти до 100%. Эффективность ингибитора определяется как его природой, так и природой корродирующего металла, и зависит от температуры.
Ингибиторы коррозии можно классифицировать по различным признакам.
1. По составу их подразделяют на две группы: неорганические и органические. В последнее время широко применяют метало- и кремнийорганические ингибиторы.
2. По областям применения ингибиторы бывают: кислотной коррозии, щелочной коррозии и коррозии в нейтральных средах.
3. По условиям применения – существуют низкотемпературные и высокотемпературные ингибиторы.
4. По особенностям механизма действия ингибиторов бывают адсорбционные и ингибиторы пассивирующего действия.
Ингибиторы коррозии пассивирующего действия для нейтральных сред делятся на:
¨ Ингибиторы окислительного типа, которые проявляют своё действие и в отсутствие кислорода воздуха. Примеры: нитрит натрия NaNO 2 , нитрит аммония NH 4 NO 2 , хромат калия K 2 CrO 4 , дихромат калия K 2 Cr 2 O 7 , молибдат натрия Na 2 MoO 4 и др.
¨ Ингибиторы, не обладающие окислительными свойствами, которые для проявления своего действия нуждаются в кислороде воздуха. Примеры: гидроксид аммония NH 4 NO 3 , гидроксид натрия NaOH, карбонат натрия Na 2 CO 3 , силикат, ортофосфат и тетраборат натрия Na 2 SiO 3 , Na 3 PO 4 и Na 2 B 4 O 7 .
Ингибиторы пассивирующего действия в нейтральных средах окислительного типа при отсутствии хлоридов и сульфатов по отношению к низкоуглеродистым сталям обладают примерно в сто раз большей эффективностью, чем ингибиторы, не обладающие окислительными свойствами. Наименьшая защитная концентрация ингибиторов–окислителей составляет 10 –3 ¸ 10 –4 %, а ингибиторов, не обладающих окислительными свойствами – 0,1 ¸ 0,05%. Ингибиторы коррозии могут вводиться в жидкие среды любой кислотности и в твёрдые материалы: масла, топлива, различные органические жидкости, лакокрасочные, полимерные, фосфатные, оксидные и другие покрытия, а также в упаковочные материалы. Наиболее перспективным является внесение в упаковочные материалы летучих ингибиторов (бензоат аммония, бензоат триэтаноламина, уротропин в смеси с нитритом натрия, нитрит дициклогексиламмония), которые, испаряясь в атмосферу внутри упаковки и адсорбируясь на поверхности металла, переводят его в пассивное состояние.
Замедление скорости коррозии связано прежде всего с исключением из коррозионного процесса части поверхности из-за её экранирования ингибитором. При выборе ингибиторов следует исходить не только из того, как они уменьшают скорость перехода металла в окружающую среду, но и из того, как они влияют на металлические свойства. Поверхностно-активные органические вещества (ПАОВ) с преобладающей катионной функцией более предпочтительны, чем с анионной функцией. Применение подобранных ингибиторов может не только предотвратить растворение металла, но и улучшить его механические свойства.
Защитное действие пассивирующих ингибиторов основано на смещении потенциала металла в положительную сторону и переводе его в пассивное состояние. Такой эффект может быть достигнут различными путями, но во всех случаях причиной снижения скорости коррозии является образование поверхностного защитного слоя. Ингибиторы могут непосредственно участвовать в образовании этого слоя.
Ингибиторы кислотной коррозии применяют при травлении изделий из черных и цветных металлов для удаления с их поверхности окалины и ржавчины, кислотной промывке теплосилового оборудования, при производстве кислот.
Действие ингибиторов атмосферной коррозии так же, как и других типов ингибиторов, сводится прежде всего к изменению ими кинетики электрохимических реакций, лежащих в основе коррозии. Эффективность любых ингибиторов зависит от их концентрации в коррозионной среде, и при некоторых минимальных значениях падает до нуля. Объем окружающей нас воздушной атмосферы практически безграничен и содержание в ней защитной концентрации ингибитора представляется экономически бессмысленно. применение ингибиторов для защиты металлов от атмосферной коррозии возможно поэтому лишь в том случае, если удается ограничить пространство, в которое помещается защищаемый объект, и отделить его от остальной атмосферы. Для этого ингибиторы вводят в смазки, полимерные и другие покрытия; помещают металл в упаковочный материал с внесением ингибитора в свободное пространство между упаковочным материалом и металлическим изделием, или в сам упаковочный материал (например, бумагу).
Словосочетания «коррозия металла» заключает в себе намного больше, чем название популярной рок-группы. Коррозия безвозвратно разрушает металл , превращая его в труху: из всего, произведенного в мире железа, 10% полностью разрушится в этот же год. Ситуация с российским металлом выглядит примерно так — весь металл, выплавленный за год в каждой шестой доменной печи нашей страны, становится ржавой трухой еще до конца года.
Выражение «обходится в копеечку» в отношении коррозии металла более чем верно — ежегодный ущерб, приносимый коррозией, составляет не менее 4% годового дохода любой развитой страны, а в России сумма ущерба исчисляется десятизначной цифрой. Так что же вызывает коррозийные процессы металлов и как с ними бороться?
Что такое коррозия металлов
Разрушение металлов в результате электрохимического (растворение во влагосодержащей воздушной или водной среде — электролите) или химического (образование соединений металлов с химическими агентами высокой агрессии) взаимодействия с внешней средой. Коррозийный процесс в металлах может развиться лишь в некоторых участках поверхности (местная коррозия), охватить всю поверхность (равномерная коррозия), или же разрушать металл по границам зерен (межкристаллитная коррозия).
Металл под воздействием кислорода и воды становится рыхлым светло-коричневым порошком, больше известным как ржавчина (Fе 2 O 3 ·H 2 О).
Химическая коррозия
Этот процесс происходит в средах, не являющихся проводниками электрического тока (сухие газы, органические жидкости — нефтепродукты, спирты и др.), причем интенсивность коррозии возрастает с повышением температуры — в результате на поверхности металлов образуется оксидная пленка.
Химической коррозии подвержены абсолютно все металлы — и черные, и цветные. Активные цветные металлы (например — алюминий) под воздействием коррозии покрываются оксидной пленкой, препятствующей глубокому окислению и защищающей металл. А такой мало активный металл, как медь, под воздействием влаги воздуха приобретает зеленоватый налет — патину. Причем оксидная пленка защищает металл от коррозии не во всех случаях — только если кристаллохимическая структура образовавшейся пленки сообразна строению металла, в противном случае — пленка ничем не поможет.

Сплавы подвержены другому типу коррозии: некоторые элементы сплавов не окисляются, а восстанавливаются (например, в сочетании высокой температуры и давления в сталях происходит восстановление водородом карбидов), при этом сплавы полностью утрачивают необходимые характеристики.
Электрохимическая коррозия
Процесс электрохимической коррозии не нуждается в обязательном погружении металла в электролит — достаточно тонкой электролитической пленки на его поверхности (часто электролитические растворы пропитывают среду, окружающую металл (бетон, почву и т.д.)). Наиболее распространенной причиной электрохимической коррозии является повсеместное применение бытовой и технической солей (хлориды натрия и калия) для устранения льда и снега на дорогах в зимний период — особенно страдают автомашины и подземные коммуникации (по статистике, ежегодные потери в США от использования солей в зимний период составляют 2,5 млрд. долларов).
Происходит следующее: металлы (сплавы) утрачивают часть атомов (они переходят в электролитический раствор в виде ионов), электроны, замещающие утраченные атомы, заряжают металл отрицательным зарядом, в то время как электролит имеет положительный заряд. Образуется гальваническая пара: металл разрушается, постепенно все его частицы становятся частью раствора. Электрохимическую коррозию могут вызывать блуждающие токи, возникающие при утечке из электрической цепи части тока в водные растворы или в почву и оттуда — в конструкции из металла. В тех местах, где блуждающие токи выходят из металлоконструкций обратно в воду или в почву, происходит разрушение металлов. Особенно часто блуждающие токи возникают в местах движения наземного электротранспорта (например, трамваев и ж/д локомотивов на электрической тяге). Всего за год блуждающие токи силой в 1А способны растворить железа — 9,1 кг, цинка — 10,7 кг, свинца — 33,4 кг.
Другие причины коррозии металла
Развитию коррозийных процессов способствуют радиация, продукты жизнедеятельности микроорганизмов и бактерий. Коррозия, вызываемая морскими микроорганизмами, наносит ущерб днищам морских судов, а коррозийные процессы, вызванные бактериями, даже имеют собственное название — биокоррозия.

Совокупность воздействия механических напряжений и внешней среды многократно ускоряет коррозию металлов — снижается их термоустойчивость, повреждаются поверхностные оксидные пленки, а в тех местах, где появляются неоднородности и трещины, активируется электрохимическая коррозия.
Меры защиты металлов от коррозии
Неизбежными последствиями технического прогресса является загрязнение нашей среды обитания — процесс, ускоряющий коррозию металлов, поскольку внешняя окружающая среда проявляет к ним все большую агрессию. Каких-либо способов полностью исключить коррозийное разрушение металлов не существует, все, что можно сделать, это максимально замедлить этот процесс.
Для минимизации разрушения металлов можно сделать следующее: снизить агрессию среды, окружающей металлическое изделие; повысить устойчивость металла к коррозии; исключить взаимодействие между металлом и веществами из внешней среды, проявляющими агрессию.
Человечеством за тысячи лет испробованы многие способы защиты металлических изделий от химической коррозии, некоторые из них применяются по сей день: покрытие жиром или маслом, другими металлами, коррозирующими в меньшей степени (самый древний метод, которому уже более 2 тыс. лет — лужение (покрытие оловом)).
Антикоррозийная защита неметаллическими покрытиями
Неметаллические покрытия — краски (алкидные, масляные и эмали), лаки (синтетические, битумные и дегтевые) и полимеры образуют защитную пленку на поверхности металлов, исключающую (при своей целостности) контакт с внешней средой и влагой.
Применение красок и лаков выгодно тем, что наносить эти защитные покрытия можно непосредственно на монтажной и строительной площадке. Методы нанесения лакокрасочных материалов просты и поддаются механизации, восстановить поврежденные покрытия можно «на месте» — во время эксплуатации, эти материалы имеют сравнительно низкую стоимость и их расход на единицу площади невелик. Однако их эффективность зависит от соблюдения нескольких условий: соответствие климатическим условиям, в которых будет эксплуатироваться металлическая конструкция; необходимость применения исключительно качественных лакокрасочных материалов ; неукоснительное следование технологии нанесения на металлические поверхности. Лакокрасочные материалы лучше всего наносить несколькими слоями — их количество обеспечит лучшую защиту от атмосферного воздействия на металлическую поверхность.

В роли защитных покрытий от коррозии могут выступать полимеры — эпоксидные смолы и полистирол, поливинилхлорид и полиэтилен. В строительных работах закладные детали из железобетона покрываются обмазками из смеси цемента и перхлорвинила, цемента и полистирола.
Защита железа от коррозии покрытиями из других металлов
Существует два типа металлических покрытий-ингибиторов — протекторные (покрытия цинком, алюминием и кадмием) и коррозионностойкие (покрытия серебром, медью, никелем, хромом и свинцом). Ингибиторы наносятся химическим способом: первая группа металлов имеет большую электроотрицательность по отношению к железу, вторая — большую электроположительность. Наибольшее распространение в нашем обиходе получили металлические покрытия железа оловом (белая жесть, из нее производят консервные банки) и цинком (оцинкованное железо — кровельное покрытие), получаемые путем протягивания листового железа через расплав одного из этих металлов.
Часто цинкованию подвергаются чугунная и стальная арматура, а также водопроводные трубы — эта операция существенно повышает их стойкость к коррозии, но только в холодной воде (при проводе горячей воды оцинкованные трубы изнашиваются быстрее неоцинкованных). Несмотря на эффективность цинкования, оно не дает идеальной защиты — цинковое покрытие часто содержит трещины, для устранения которых требуется предварительное никелерование металлических поверхностей (покрытие никелем). Цинковые покрытия не позволяют наносить на них лакокрасочные материалы — нет устойчивого покрытия.
Лучшее решение для антикоррозийной защиты — алюминиевое покрытие. Этот металл имеет меньший удельный вес, а значит — меньше расходуется, алюминированные поверхности можно окрашивать и слой лакокрасочного покрытия будет устойчив. Кроме того, алюминиевое покрытие по сравнению с оцинкованным покрытием обладает большей стойкостью в агрессивных средах. Алюминирование слабо распространено из-за сложности нанесения этого покрытия на металлический лист — алюминий в расплавленном состоянии проявляет высокую агрессию к другим металлам (по этой причине расплав алюминия нельзя содержать в стальной ванне). Возможно, эта проблема будет полностью решена в самое ближайшее время — оригинальный способ выполнения алюминирования найден российскими учеными. Суть разработки заключается в том, чтобы не погружать стальной лист в расплав алюминия, а поднять жидкий алюминий к стальному листу.
Повышение коррозийной стойкости путем добавления в стальные сплавы легирующих добавок
Введение в стальной сплав хрома, титана, марганца, никеля и меди позволяет получить легированную сталь с высокими антикоррозийными свойствами. Особенную стойкость стальному сплаву придает большая доля хрома, благодаря которому на поверхности конструкций образуется оксидная пленка большой плотности. Введение в состав низколегированных и углеродистых сталей меди (от 0,2% до 0,5%) позволяет повысить их коррозийную устойчивость в 1,5-2 раза. Легирующие добавки вводятся в состав стали с соблюдением правила Таммана: высокая коррозийная устойчивость достигается, когда на восемь атомов железа приходится один атом легирующего металла.
Меры противодействия электрохимической коррозии
Для ее снижения необходимо понизить коррозийную активность среды посредством введения неметаллических ингибиторов и уменьшить количество компонентов, способных начать электрохимическую реакцию. Таким способом будет понижение кислотности почв и водных растворов, контактирующих с металлами. Для снижения коррозии железа (его сплавов), а также латуни, меди, свинца и цинка из водных растворов необходимо удалить диоксид углерода и кислород. В электроэнергетической отрасли проводится удаление из воды хлоридов, способных повлиять на локальную коррозию. С помощью известкования почвы можно снизить ее кислотность.
Защита от блуждающих токов
Снизить электрокоррозию подземных коммуникаций и заглубленных металлоконструкций возможно при соблюдении нескольких правил:
- участок конструкции, служащий источником блуждающего тока, необходимо соединить металлическим проводником с рельсом трамвайной дороги;
- трассы теплосетей должны размещаться на максимальном удалении от рельсовых дорог, по которым передвигается электротранспорт, свести к минимуму число их пересечений;
- применение электроизоляционных трубных опор для повышения переходного сопротивления между грунтом и трубопроводами;
- на вводах к объектам (потенциальным источникам блуждающих токов) необходима установка изолирующих фланцев;
- на фланцевой арматуре и сальниковых компенсаторах устанавливать токопроводящие продольные перемычки — для наращивания продольной электропроводимости на защищаемом отрезке трубопроводов;
- чтобы выровнять потенциалы трубопроводов, расположенных параллельно, необходимо установить поперечные электроперемычки на смежных участках.
Защита металлических объектов, снабженных изоляцией, а также стальных конструкций небольшого размера выполняется с помощью протектора, выполняющего функцию анода. Материалом для протектора служит один из активных металлов (цинк, магний, алюминий и их сплавы) — он принимает на себя большую часть электрохимической коррозии, разрушаясь и сохраняя главную конструкцию. Один анод из магния, к примеру, обеспечивает защиту 8 км трубопровода.
Абдюжанов Рустам, специально для рмнт.ру
Все мы в своей жизни периодически сталкиваемся с различными видами коррозий. Бывают коррозии металла, бетона и некоторых видов пластмасс. Что бы научиться правильно бороться с коррозией первоначально необходимо понять, что же такое коррозия.
Коррозия – это разрушение твердых тел, вызванное химическими и электрохимическими процессами, развивающимися на поверхности тела при его взаимодействии с внешней средой. Даже само слово коррозия произошло от позднелатинского corrosio – разъедание. Особенный ущерб приносит коррозия металлов. Распространенный и наиболее знакомый всем нам вид коррозии – ржавление железа. Термин «коррозия» применим к металлам, бетону, некоторым пластмассам и другим материалам. Кроме коррозии, металлические (в частности, строительные) конструкции подвергаются действию эрозии – разрушению поверхности материала под влиянием механического воздействия. Эрозию провоцируют дожди, ветры, песчаная пыль и прочие природные факторы. Поэтому арки мостов, строительные фермы и другие сооружения надо защищать комплексно. Таким образом, коррозия – это физико-химическое взаимодействие металла со средой, ведущее к разрушению металла. В результате коррозии металлы переходят в устойчивые соединения – оксиды или соли, в виде которых они находятся в природе. Коррозия съедает до 10 процентов производимого в стране металла. Трудно учесть более высокие косвенные потери от простоев и снижения производительности оборудования, подвергшегося коррозии, от нарушения нормального хода технологических процессов, от аварий, обусловленных снижением прочности металлических конструкций и т.п.
Почему коррозия называется коррозией?
Слово коррозия происходит от латинского «corrodo» – «грызу». Некоторые источники ссылаются на позднелатинское «corrosio» – «разъедание». Не следует путать понятия «коррозия» и «ржавчина». Если коррозия – это процесс, то ржавчина один из его результатов. Это слово применимо только к железу, входящему в состав стали и чугуна. В дальнейшем под термином «коррозия» мы будем подразумевать коррозию металлов. Согласно международному стандарту ISO 8044 под коррозией понимают физико-химическое или химическое взаимодействие между металлом (сплавом) и средой, приводящее к ухудшению функциональных свойств металла (сплава), среды или включающей их технической системы. РЖАВЧИНА – это слой частично гидратированных оксидов железа, образующийся на поверхности железа и некоторых его сплавов в результате коррозии. Коррозионному разрушению подвержены также бетон, строительный камень, дерево, другие материалы; коррозия полимеров называется деструкцией.
Среда, в которой металл подвергается коррозии (корродирует) называется коррозионной или агрессивной средой. В случае с металлами, говоря об их коррозии, имеют ввиду нежелательный процесс взаимодействия металла со средой.
Физико-химическая сущность изменений, которые претерпевает металл при коррозии, является окисление металла. Любой коррозионный процесс является многостадийным:
- Необходим подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- Взаимодействие среды с металлом.
- Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
Известно, что большинство металлов (кроме Ag, Pt ,Cu, Au) встречаются в природе в ионном состоянии: оксиды, сульфиды, карбонаты и др., называемые обычно рудами металлов. Ионное состояние более выгодно, оно характеризуется меньшей внутренней энергией. Это заметно при получении металлов из руд и их коррозии. Поглощенная энергия при восстановлении металла из соединений свидетельствует о том, что свободный металл обладает более высокой энергией, чем металлическое соединение. Это приводит к тому, что металл, находящийся в контакте с коррозионно-активной средой стремится перейти в энергетически выгодное состояние с меньшим запасом энергии. То есть можно сказать, что первопричиной коррозии является термодинамическая неустойчивость системы, состоящей из металла и компонентов окружающей (коррозионной) среды. Мерой термодинамической неустойчивости является свободная энергия, освобождаемая при взаимодействии металла с этими компонентами. Но свободная энергия сама по себе ещё не определяет скорость коррозионного процесса, т. е. величину, наиболее важную для оценки коррозионной стойкости металла. В ряде случаев адсорбционные или фазовые слои (плёнки), возникающие на поверхности металла в результате начавшегося коррозионного процесса образуют настолько плотный и непроницаемый барьер, что коррозия прекращается или очень сильно тормозится. Поэтому в условиях эксплуатации металл, обладающий большим сродством к кислороду, может оказаться не менее, а более стойким (так, свободная энергия образования окисла у Cr или Al выше, чем у Fe, а по стойкости они часто превосходят Fe).
Классификация коррозионных процессов
По виду (геометрическому характеру) коррозионных разрушений на поверхности или в объёме металла.
Коррозию, захватившая всю поверхность металла, называется сплошной . Её делят на равномерную и неравномерную , в зависимости от того, одинакова ли глубина коррозионного разрушения на разных участках. При местной коррозии поражения локальны и оставляют практически незатронутой значительную (иногда подавляющую) часть поверхности. В зависимости от степени локализации различают коррозионные пятна, язвы и точки (питтинг) . Точечные поражения могут дать начало подповерхностной коррозии, распространяющейся в стороны под очень тонким (например, наклёпанным) слоем металла, который затем вздувается пузырями или шелушится. Наиболее опасные виды местной коррозии – межкристаллитная (интеркристаллитная) , которая, не разрушая зёрен металла, продвигается вглубь по их менее стойким границам, и транскристаллитная, рассекающая металл трещиной прямо через зёрна. Почти не оставляя видимых следов на поверхности, эти поражения могут приводить к полной потере прочности и разрушению детали или конструкции. Близка к ним по характеру ножевая коррозия, словно ножом разрезающая металл вдоль сварного шва при эксплуатации некоторых сплавов в особо агрессивных растворах. Иногда специально выделяют поверхностную нитевидную коррозию, развивающуюся, например, под неметаллическими покрытиями, и послойную коррозию, идущую преимущественно в направлении пластической деформации. Специфична избирательная коррозия, при которой в сплаве могут избирательно растворяться даже отдельные компоненты твёрдых растворов (например, обесцинкование латуней).
По механизму реакций взаимодействия металла со средой (химическая и электрохимическая коррозия).
Коррозия является химической , если после разрыва металлической связи атомы металла непосредственно соединяются химической связью с теми атомами или группами атомов, которые входят в состав окислителей, отнимающих валентные электроны металла. Химическая коррозия возможна в любой коррозионной среде, однако чаще всего она наблюдается в тех случаях, когда коррозионная среда не является электролитом (газовая коррозия, коррозия в неэлектропроводных органических жидкостях). Скорость её чаще всего определяется диффузией частиц металла и окислителя через поверхностную плёнку продуктов коррозии (высокотемпературное окисление большинства металлов газами), иногда – растворением или испарением этой плёнки (высокотемпературное окисление W или Mo), её растрескиванием (окисление Nb при высоких температурах) и изредка – конвективной доставкой окислителя из внешней среды (при очень малых его концентрациях).
Коррозия является электрохимической , если при выходе из металлической решётки образующийся катион вступает в связь не с окислителем, а с другими компонентами коррозионной среды; окислителю же передаются электроны, освобождающиеся при образовании катиона. Такой процесс возможен в тех случаях, когда в окружающей среде существуют два типа реагентов, из которых одни (сольватирующие или комплексообразующие) способны соединяться устойчивыми связями с катионом металла без участия его валентных электронов, а другие (окислители) могут присоединять валентные электроны металла, не удерживая около себя катионы. Подобными свойствами обладают растворы или расплавы электролитов, где сольватированные катионы сохраняют значительную подвижность. Таким образом, при электрохимической коррозии удаление атома из металлической решётки (что составляет суть любого коррозионного процесса) осуществляется в результате двух независимых, но сопряжённых, связанных между собой электрическим балансом, электрохимических процессов: анодного – переход сольватируемых катионов металла в раствор, и катодного – связывание окислителем освобождающихся электронов. Отсюда следует, что процесс электрохимической коррозии можно замедлить не только путём непосредственного торможения анодного процесса, но также воздействуя на скорость катодного. Наиболее распространены два катодных процесса: разряд водородных ионов (2е + 2H + = H 2) и восстановление растворённого кислорода (4е + O 2 + 4H + = 2H 2 O или 4е + O 2 + 2H 2 O = 4ОН -), которые часто называют соответственно водородной и кислородной деполяризацией.
Анодный и катодный процессы с той или иной вероятностью и в той или иной последовательности протекают в любых точках металлической поверхности, где катионы и электроны могут взаимодействовать с компонентами коррозионной среды. Если поверхность однородна, то катодные и анодные процессы равновероятны по всей её площади; в таком идеальном случае коррозию называют гомогенно-электрохимической (отмечая, таким образом, отсутствие какой-либо неоднородности в распределении вероятности электрохимических процессов в любой точке поверхности, что, конечно, не исключает термодинамической гетерогенности взаимодействующих фаз). В действительности на металлических поверхностях существуют участки с различными условиями доставки реагирующих компонентов, с разным энергетическим состоянием атомов или с различными примесями. На таких участках возможно более энергичное протекание либо анодного, либо катодного процессов, и коррозия становится гетерогенно-электрохимической.
По типу коррозионной среды
Некоторые коррозионные среды и вызываемые ими разрушения столь характерны, что по названию этих сред классифицируются и протекающие в них коррозионные процессы.
Как правило, металлические изделия и конструкции подвергаются действию многих видов коррозии – в этих случаях говорят о действии так называемой смешанной коррозии.
Газовая коррозия – коррозия в газовой среде при высоких температурах.
Атмосферная коррозия – коррозия металла в условиях атмосферы при влажности, достаточной для образования на поверхности металла пленки электролита (особенно в присутствии агрессивных газов или аэрозолей кислот, солей и т.д.). Особенностью атмосферной коррозии является сильная зависимость ее скорости и механизма от толщины слоя влаги на поверхности металла или степени увлажнения образовавшихся продуктов коррозии.
Жидкостная коррозия – коррозия в жидких средах. По условиям воздействия жидкой среды на металл этот тип коррозии также характеризуется как коррозия при полном погружении, при неполном погружении, при переменном погружении, имеющие свои характерные особенности.
Подземная коррозия – коррозия металла в грунтах и почвах. Характерной особенностью подземной коррозии является большое различие в скорости доставки кислорода (основной деполяризатор) к поверхности подземных конструкций в разных почвах (в десятки тысяч раз).
По характеру дополнительных воздействий
Коррозия под напряжением развивается в зоне действия растягивающих или изгибающих механических нагрузок, а также остаточных деформаций или термических напряжений и, как правило, ведёт к транскристаллитному коррозионному растрескиванию , которому подвержены, например, стальные тросы и пружины в атмосферных условиях, углеродистые и нержавеющие стали в паросиловых установках, высокопрочные титановые сплавы в морской воде и т. д. При знакопеременных нагрузках может проявляться коррозионная усталость, выражающаяся в более или менее резком понижении предела усталости металла в присутствии коррозионной среды. Коррозионная эрозия (или коррозия при трении) представляет собой ускоренный износ металла при одновременном воздействии взаимно усиливающих друг друга коррозионных и абразивных факторов (трение скольжения, поток абразивных частиц и т. п.). Родственная ей кавитационная коррозия возникает при кавитационных режимах обтекания металла агрессивной средой, когда непрерывное возникновение и «захлопывание» мелких вакуумных пузырьков создаёт поток разрушающих микрогидравлических ударов, воздействующих на поверхность металла. Близкой разновидностью можно считать и фреттинг -коррозию, наблюдаемую в местах контакта плотно сжатых или катящихся одна по другой деталей, если в результате вибраций между их поверхностями возникают микроскопические смещения сдвига.
Утечка электрического тока через границу металла с агрессивной средой вызывает в зависимости от характера и направления утечки дополнительные анодные и катодные реакции, могущие прямо или косвенно вести к ускоренному местному или общему разрушению металла (коррозия блуждающим током ). Сходные разрушения, локализуемые вблизи контакта, может вызвать соприкосновение в электролите двух разнородных металлов, образующих замкнутый гальванический элемент, – контактная коррозия. В узких зазорах между деталями, а также под отставшим покрытием или наростом, куда проникает электролит, но затруднён доступ кислорода, необходимого для пассивации металла, может развиваться щелевая коррозия, при которой растворение металла в основном происходит в щели, а катодные реакции частично или полностью протекают рядом с ней на открытой поверхности.
Принято выделять также биологическую коррозию, идущую под влиянием продуктов жизнедеятельности бактерий и др. организмов, и радиационную коррозию – при воздействии радиоактивного излучения.
Показатель скорости коррозии
Для установления скорости коррозии металла в данной среде обычно ведут наблюдения за изменением во времени какой-либо характеристики, объективно отражающей изменение свойства металла. Чаще всего в коррозионной практике используют следующие показатели.
Показатель изменения массы
Показатель изменения массы – изменение массы образца в результате коррозии, отнесенное к единице поверхности металла S и к единице времени (например, г/м ч).
В зависимости от условий коррозии различают:
1. отрицательный показатель изменения массы
К-m=
где m – убыль массы металла за время коррозии после удаления продуктов коррозии.
2. положительный показатель изменения массы К+m=
где m – увеличение массы металла за время вследствие роста пленки продуктов коррозии.
Если состав продуктов коррозии известен, то можно сделать пересчет от К к К и наоборот К-m= К+m (nok A Me / n Me Aok)
где А и М – атомная и молекулярная масса Ме и окислителя соответственно; n и n валентность металла и окислителя в окислительной среде.
Объемный показатель коррозии
К – объем поглощенного или выделившегося в процессе газа V отнесенный к единице поверхности металла и единице времени (например, см/см ч).
К= об. V / s
объем газа обычно приводят к нормальным условиям.
Применительно к электрохимической коррозии когда процесс катодной деполяризации осуществляется за счет разряда ионов водорода, например, по схеме 2Н + 2е
= Н, или ионизация молекул кислорода О + 4е
+2НО = 4ОН; вводятся соответственно кислородный (К) и водородный (К) показатель соответственно.
Водородный показатель коррозии – это объем выделившегося Н в процессе коррозии, отнесенный к Su.
Кислородный показатель коррозии – это объем поглощенного в процессе О, отнесенный к Su.
Показатель сопротивления
Изменение электрического сопротивления образца металла за определенное время испытаний также может быть использован в качестве показания коррозии (К).
КR = (R/Ro) 100% за время t
где Ro и R – электрическое сопротивление образца соответственно до и после коррозии.
У этого способа есть некоторый недостаток толщина металла во все время испытаний должна быть одинаковой и по этой причине чаще всего определяют удельное сопротивление, т.е. изменение электрического сопротивления на единицу площади образца (см, мм) при длине равной единице. Этот метод имеет ограничения применения (для листового металла не более 3мм). Наиболее точные данные получают для проволочных образцов. Этот метод не пригоден для сварных соединений.
Механический показатель коррозии
Изменение какого-либо свойства металла за время коррозии. Сравнительно часто пользуются изменением предела прочности. Прочностной показатель при этом выражается:
Кo = (в/во) 100% за время t
где в – изменение предела прочности при растяжении после коррозии образца в течение времени; во – предел прочности до коррозии.
Глубинный показатель коррозии
К – глубина разрушения металла П в единицу времени (например, мм/год).
Глубина коррозионного разрушения П может быть средней или максимальной. Глубинный показатель коррозии можно использовать для характеристики как равномерной, так и неравномерной коррозии (в том числе и местной) металлов. Он удобен для сравнения скорости коррозии металла с различными плотностями. Переход от массового, токового и объемного к глубинному возможен при равномерной коррозии.
Коррозии поддаются многие материалы, например металлические, керамические, деревянные, в результате воздействия на них. Как правило, такой эффект достигается из-за неустойчивости конструкции, на которую воздействует термодинамика окружающей среды. В статье подробно разберемся, что такое коррозия металла, какие она имеет виды, а также как можно от нее защититься.
Немного общих сведений
В народе довольно популярным является слово "ржавчина", которое относится к процессу коррозии металла и различных сплавов. К полимерам люди используют понятия “старение”. По факту эти слова являются синонимами. Ярким примером можно назвать старение резиновых продуктов, которые активно взаимодействуют с кислородом. Некоторые пластиковые изделия из-за осадков могут быстро приходить в негодность. То, насколько быстро будет происходить процесс коррозии, полностью зависит от условий, в которые помещено изделие. Особенно влияет влажность окружающей среды. Чем больше ее показатель, тем быстрее металл станет непригодным к использованию. Опытным путем учеными было установлено, что около 10 % изделий на производстве просто списывается из-за коррозии. Виды данного процесса различные, их классификация зависит от типа среды, в которой изделия находятся, скорости и характера протекания. Далее рассмотрим более подробно типы коррозии. Теперь каждый человек должен понимать, что такое коррозия металла.

Искусственное старение
Процесс коррозии не всегда имеет разрушительное влияние и приводит в негодность определенные материалы. Нередко из-за коррозии у покрытия появляются дополнительные свойства, необходимые человеку. Именно поэтому популярным стало искусственное старение. Чаще всего его применяют, если речь идет об алюминии и титане. Только при помощи коррозии можно добиться повышенной прочности материалов. Для того чтобы завершить процесс разрушения правильно, необходимо использовать термическую обработку. Учитывая, что естественное старение материалов в некоторых условиях довольно медленный процесс, то не нужно уточнять, что при использовании этого метода материал должен иметь специальную закалку. Нужно также понимать все риски, которые связаны с данным методом. Например, хотя и прочность материала повышается, но пластичность максимально уменьшается. С легкостью теперь читатель сможет ответить на вопрос о том, что такое коррозия металла искусственного типа.

Отзывы о термической обработке
Данный метод уплотняет молекулы материала, соответственно, меняется структура. Нередко термическая защита необходима для укрепления трубопроводов, так как она позволяет уберечь материал от ржавчины, а также минимизировать давление, которое оказывается на конструкцию, если оно находится под землей. Пользователи этой методики оставляют отзывы, в которых описывают, что данный метод защиты максимально эффективен и действительно показывает хорошие результаты. Такую обработку желательно применять только в промышленной сфере. Из-за того что камеры для обжига и совершения других процессов, необходимые для получения надежной защиты, стоят дорого, метод популярностью не пользуются. Такая защита металла от коррозии довольно эффективна.
Классификация
На данный момент существует более 20 вариантов ржавения. В статье будут описаны только наиболее популярные виды коррозии. Условно они делятся на следующие группы, которые помогут понять подробнее, что такое коррозия металла.
Химическая коррозия - это взаимодействие с коррозионной средой. При этом окисление металла и восстановление окислителя происходит одновременно в одном цикле. Оба материала не разделяются при помощи пространства. Рассмотрим другие виды коррозии металлов.
Электрохимическая коррозия - это взаимодействие металла с электролитом. Атомы ионизируются, окислитель восстанавливается, а эти два процесса происходит за несколько циклов. Их скорость полностью зависит от потенциала электродов.
При газовой коррозии происходит ржавление металла с небольшим содержанием жидкости. Влага не должна превышать 0,1 %. Также данный вид коррозии может происходить в газовой среде при высоких температурах. Наиболее чаще этот вид встречается в промышленности, связанной с химической сферой и нефтеперерабатывающей.
Помимо вышеописанных существует еще множество видов коррозии материалов. Имеются биологическое, целевое, контактное, местное и другие виды ржавения.

Электрохимическая коррозия и ее особенности
При электрохимической коррозии разрушение материала происходит из-за его прикосновения к электролиту. В качестве последнего вещества может быть конденсат, дождевая вода. Нужно заметить, что чем больше будет солей в жидкости, тем выше показатель электропроводности. Соответственно, процесс коррозии будет протекать довольно быстро. Если говорить о наиболее популярных местах, которые поддаются коррозии, нужно отметить заклепки в металлической конструкции, сварные соединения, а также просто места, в которых материал поврежден. Бывает так, что сплав железа при его создании покрыт специальными веществами, которые имеют антикоррозионные свойства. Однако это не предотвращает процесс ржавения, а лишь его замедляет. Довольно ярким примером можно назвать оцинковку. Цинк имеет отрицательный потенциал, если сравнивать с железом. Из-за этого последний материал будет восстанавливаться, а цинк повредится. Если на поверхности будет находиться оксидная пленка, то процесс разрушения станет длительным. Электрохимическая коррозия имеет несколько видов, но нужно отметить, что все они опасные и, как правило, остановить такой вид коррозии металлов невозможно.
Химическая коррозия
Химическая коррозия встречается довольно часто. Например, если человек замечает окалину, то он должен понимать, что она появилась в результате соединения металла, то есть взаимодействия, с кислородом. Как правило, если температура окружающей среды высокая, то процесс коррозии будет заметно ускорен. Участвовать в ржавении могут жидкость, то есть вода, соль, любая кислота или щелочь, растворы солей. Если речь идет о химической коррозии металлов, таких как медь или цинк, что их окисление приводит к устойчивому процессу коррозии пленки. Остальные же формируют окись железа. Далее все химические процессы, которые будут происходить, приведут к появлению ржавчины. Она никак не будет обеспечивать защиту, а наоборот, способствует возникновению коррозии. При помощи оцинковки на данный момент можно защитить многие материалы. Также разработаны и другие средства защиты от химической коррозии металлов.

Виды коррозии бетона
Хрупкость бетона может вызываться одним из трех видов коррозии. Довольно нередко встречается изменение структуры данного материала. Рассмотрим же, из-за чего это происходит.
Наиболее распространенным видом коррозии следует назвать разрушение цементного камня. Как правило, это происходит тогда, когда жидкость и атмосферные осадки постоянно воздействуют на материал. Из-за этого структура материала разрушается. Ниже есть более подробные примеры коррозии металлов:
- Взаимодействие с кислотами. Если цементный камень будет постоянно под воздействием данных материалов, то образуется довольно агрессивный элемент, который вреден для покрытия. Речь идет о бикарбонате кальция.
- Кристаллизация труднорастворимых веществ. Здесь речь идет о коррозии. Из-за того что грибки, споры и другие вещества попадают в поры, бетонное покрытие начинает быстро разрушаться.
Коррозия: способы защиты
Из-за коррозии производители часто терпят огромные убытки, поэтому ведется огромная работа, которая позволит избежать данного процесса. Причем нужно заметить, что чаще всего коррозии поддается не сам металл, а огромные металлоконструкции. На их создание производители тратят огромные деньги. К сожалению, обеспечить защиту на все 100 % практически невозможно. Однако, если правильно защищать поверхность, то есть проводить абразивоструйную очистку, можно отсрочить процесс коррозии на несколько лет. Также с ней борются лакокрасочным покрытием. Оно надежно защищает материал. Если металл находится под землей, то его необходимо обрабатывать специальными материалами. Только так можно добиться максимальной защиты металла от коррозии.
Меры предотвращения старения
Как уже было сказано выше, процесс коррозии остановить нельзя. Но можно максимально увеличить время, за которое материал будет разрушаться. Также на производстве, как правило, стараются максимально избавиться от факторов, которые влияют на процесс старения. Например, на заводах периодически каждую конструкцию обрабатывают растворами и полиролями. Именно они избавляют материал от негативного влияния на металл со стороны механических, температурных и химических условий. Для того чтобы подробнее в этом разбираться, следует изучить определение коррозии металлов. Если говорить о замедлении эффекта старения, то следует выделить, что для этого можно использовать термическую обработку. В нормальных условиях эксплуатации этот метод позволит максимально избежать быстрого разрушения материала. Сварщики для того, чтобы швы на изделии не разошлись, используют обжиг при температуре в 650 градусов. Такая методика позволит уменьшить интенсивность старения.

Активные и пассивные методы борьбы
Активные способы борьбы с коррозией действуют, изменяя структуру электрического поля. Для этого необходимо использовать постоянный ток. Напряжение должно быть таким, чтобы изделие имело повышенные характеристики. Довольно популярным методом будет использование “жертвенного” анода. Он защищает материал путем собственного разрушения. Условия коррозии металлов описаны выше.
Что касается пассивной защиты, то для этого используется лакокрасочное покрытие. Оно полностью защищает изделие от попадания жидкости, а также кислорода. Благодаря этому поверхность максимально защищена от разрушения. Следует использовать напыление из цинка, меди, никеля. Даже если слой будет сильно разрушен, он он все равно защитит металл от ржавения. Конечно, нужно понимать, что пассивные методы защиты будут актуальными только в том случае, если поверхность не имеет трещины или сколы.
Отзывы о лакокрасочной защите металлов
На данный момент лакокрасочная защита пользуется особой популярностью. Она эффективна, гибка в применении, а также стоит недорого. Однако если необходимо длительное использование металлической конструкции, то такой метод защиты не подойдет. Более чем 7-8 лет лакокрасочные покрытия защищать материал не смогут. Соответственно, их придется обновлять. Скорее всего, придется проводить реставрацию и заменять поверхность материала. Среди других недостатков данного покрытия нужно отметить ограничения в плане использования. Если необходимо усилить трубы, которые находятся под землей или водой, то лакокрасочная защита не подойдет. Поэтому следует понимать, что, если необходимо, чтобы конструкция использовалась более 10 лет, следует прибегнуть к другим методам защиты.
Оцинкование в подробностях
Рассмотрев основные виды коррозии, необходимо также обсудить наиболее эффективные методы защиты. Одним из таковых можно назвать оцинкование. Оно позволяет защищать материал от сильных разрушений путем изменения физико-химических свойств. На данный момент этот метод считается экономным и эффективным, учитывая, что на обработку цинком тратится практически 40 % от всего добываемого материала на Земле. Важно обработать материал антикоррозийным покрытием.
Оцинкование проводится для стальных листов, крепежных деталей, приборов и огромных металлоконструкций. В целом при помощи подобного распыления можно защитить изделия любого размера и формы. Цинк не имеет никакого декоративного назначения, хотя изредка может добавляться в сплав для получения блеска. В целом нужно понимать, что данный металл позволит максимально защитить от коррозии даже в самых агрессивных условиях.
Особенности защитных средств от ржавчины
При работе с металлом любой человек понимает, что перед тем как наносить защитные материалы, необходимо подготовить поверхность. Зачастую все трудности заключаются именно в этом этапе. Для того чтобы создать специальный барьер, который позволит ржавчине добираться до металла, необходимо ввести понятие компаунда. Благодаря ему в комплекте сформируется защита от коррозии. При этом имеет место электроизоляция. Обычно довольно сложно защищаться от коррозии черных металлов.
Из-за специфики использования различных средств для защиты необходимо понимать условия эксплуатации материала. Если металл будет располагаться под землей, то необходимо использовать многослойные покрытия, которые будут иметь не только антикоррозионные свойства, но и усиленную защиту от механических повреждений. Если речь идет о коммуникациях, которые активно взаимодействуют с кислородом и газами, следует использовать средство, минимизирующее воздействие воды и кислорода. Соответственно, повышенное внимание со стороны производителя будет уделяться изоляции от влаги, пара и низких температур. В таком случае следует добавлять присадки и специальные пластификаторы, ведь причины коррозии металлов различны и защищаться следует от всех видов.
Смесь "Уризол"
Смесь “Уризол” следует рассмотреть отдельно, так как ее используют для покрытия трубопровода. Также она подойдет для фитингов, соединительных деталей, крановых узлов и тех изделий, которые постоянно контактируют с нефтью или газами. Данный состав нужен для того, чтобы избавиться от влияния подземных и атмосферных воздействий. Нередко данная смесь также применяется для изоляции бетонных материалов. Данное вещество наносится очень просто, без какого-либо труда. Для того чтобы обработать поверхность, необходимо использовать распылитель. Только так можно избежать коррозии металлов и сплавов подобных изделий. Как только компоненты соединяются, начинается реакция. Из-за этого возникает полимочевина. После этого смесь переходит в гелеобразное и нетекучее состояние, а после некоторого времени становится твердой. Если скорость полимеризации будет медленной, то начнут образовываться подтеки. Они вредные, так как из-за них трудно наращивать толщину покрытия. Нужно заметить, что эта смесь долгое время сохраняет липкое состояние. За счет этого все слои будут максимально равномерными, а промежуточные замеры толщины сравняются между собой. Если процесс полимеризации будет слишком быстрым, то адгезия состава уменьшится. При этом толщина получаемого слоя для изоляции будет неравномерной. К слову, распылительный пистолет быстро засоряется, если скорость покрытия слишком быстрая. Факторы коррозии металлов не будут появляться, если сделать все верно. Для того чтобы предупредить подобные ситуации, необходимо тщательно подбирать компоненты и соблюдать правила изготовления.

Краски и эмали
Защиту металлопластиковых конструкций можно провести при помощи трех способов.
Ранее уже были описаны лакокрасочные покрытия. Они просты, имеют разнообразные цветовое решение, а также с помощью них можно с легкостью обрабатывать огромные поверхности. Так как процесс коррозии металла довольно быстрый, то и задуматься о покрытии материалами следует сразу же.
Второй вид - это пластмассовые покрытия. Как правило, они создаются из нейлона, ПВХ. Данное покрытие будет максимально защищать от воды, кислот и щелочей.
Третий вид - это покрытие каучуком. Зачастую его используют для защиты резервуаров и других конструкций с внутренней стороны.
Фосфатирование и хроматирование
Металлическую поверхность следует правильно подготовить к процессу защиты. То, какие методы будут использоваться, полностью зависит от типа поверхности. Например, черные металлы защищают при помощи фосфатирования. Цветные металлы можно обрабатывать обоими методами. В целом, если говорить о химической подготовке, необходимо уточнить, что она проходит в несколько этапов. Для начала поверхность обезжиривается. Затем промывается при помощи воды. Далее наносится конверсионный слой. После повторно промывается двумя типами воды: питьевой и деминерализованной соответственно. Далее осталось провести пассивацию. Химическую обработку следует проводить при помощи распыления, погружения, а также пароструйного и гидроструйного методов. Первые два способа необходимо применять при помощи специальных агрегатов, которые полностью подготовят поверхность к работе. То, какой метод выбрать, необходимо решать зависимости от размеров, конфигурации изделия и так далее. Для того чтобы лучше разобраться в этом вопросе, следует знать уравнения реакций коррозии металлов.

Заключение
В статье было описано, что такое коррозия и какие виды она имеет. Сейчас уже любой человек после прочтения данной статьи сможет понять, как защитить любой материал от старения. По большому счету сделать это довольно легко, зная все необходимые инструкции. Главное - понимать все характеристики окружающей среды, в которой материал используется. Если изделия находятся в месте, где происходят постоянные вибрации, а также имеются сильнейшие нагрузки, то в лакокрасочных покрытиях будут возникать трещины. Из-за этого на металл станет попадать влага, соответственно, процесс коррозии начинается незамедлительно. В таких случаях лучше дополнительно использовать резиновые герметики и прокладки, тогда покрытие будет служить немного дольше.
Дополнительно нужно сказать, что конструкция при преждевременной деформации будет быстро портиться и стареть. Соответственно, это может привести к совершенно непредвиденным обстоятельствам. Это будет приносить материальную ущерб и может закончиться гибелью человека. Соответственно, защите от коррозии следует уделять особое внимание.