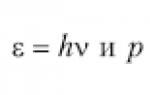டி ப்ரோக்லியின் கருதுகோள் உருவாக்கம். டி ப்ரோக்லியின் கருதுகோள் மற்றும் சூத்திரம். கருதுகோளின் சோதனை உறுதிப்படுத்தல். இரட்டை துகள்-அலை இயல்பு
A).பிரெஞ்சு விஞ்ஞானி லூயிஸ் டி ப்ரோக்லி (1892-1987) 1924 இல், "குவாண்டம் கோட்பாடு பற்றிய ஆய்வுகள்" என்ற தனது முனைவர் ஆய்வுக் கட்டுரையில் அலை-துகள் இருமையின் உலகளாவிய தன்மையைப் பற்றி ஒரு தைரியமான கருதுகோளை முன்வைத்தார், ஏனெனில் ஒளி சில சமயங்களில் அலையாக செயல்படுகிறது என்று வாதிட்டார். , மற்றும் பிறவற்றில் - ஒரு துகள், பின்னர் பொருள் துகள்கள் (எலக்ட்ரான்கள், முதலியன), இயற்கையின் விதிகளின் பொதுத்தன்மையின் காரணமாக, அலை பண்புகளைக் கொண்டிருக்க வேண்டும். "ஒளியியலில்," அவர் எழுதினார், "ஒரு நூற்றாண்டு காலமாக, அலையுடன் ஒப்பிடுகையில் கார்பஸ்குலர் தேர்வு முறை மிகவும் புறக்கணிக்கப்பட்டது; பொருளின் கோட்பாட்டில் நேர்மாறான தவறு செய்யப்படவில்லையா? “துகள்” படத்தைப் பற்றி அதிகம் யோசித்து அலை படத்தைப் புறக்கணித்துவிட்டோமா?” அந்த நேரத்தில், டி ப்ரோக்லியின் கருதுகோள் பைத்தியமாகத் தோன்றியது. 1927 இல், மூன்று ஆண்டுகளுக்குப் பிறகு, விஞ்ஞானம் ஒரு பெரிய அதிர்ச்சியை அனுபவித்தது: இயற்பியலாளர்கள் கே. டேவிசன் மற்றும் எல். ஜெர்மர் ஆகியோர் டி ப்ரோக்லியின் கருதுகோளை எலக்ட்ரான்களின் மாறுபாடு வடிவத்தைப் பெறுவதன் மூலம் சோதனை முறையில் உறுதிப்படுத்தினர்.
A. ஐன்ஸ்டீனின் ஒளியின் குவாண்டம் கோட்பாட்டின் படி, ஒளியின் ஃபோட்டான்களின் அலை பண்புகள் (ஊசலாட்ட அதிர்வெண் v f, சார்பியல் நிறை m f மற்றும் உந்தம் p f) உறவுகள்:
டி ப்ரோக்லியின் யோசனையின்படி, எந்த நுண் துகள்களும், ஓய்வு நிறை w 0 உள்ள ஒன்று உட்பட சி 0, கார்பஸ்குலர் மட்டுமல்ல, அலை பண்புகளையும் கொண்டிருக்க வேண்டும். தொடர்புடைய அதிர்வெண் vமற்றும் அலைநீளம் l ஐன்ஸ்டீன் போன்ற உறவுகளால் தீர்மானிக்கப்படுகிறது:
![]()
எனவே டி ப்ரோக்லி அலைநீளம்
எனவே, டி ப்ரோக்லி முன்வைத்த கருதுகோளின் விளைவாக ஃபோட்டான்களின் கோட்பாட்டை உருவாக்கும்போது ஐன்ஸ்டீனின் உறவுகள் உலகளாவிய தன்மையைப் பெற்றன, மேலும் ஒளியின் கார்பஸ்குலர் பண்புகளை பகுப்பாய்வு செய்வதற்கும் ஆய்வு செய்வதற்கும் சமமாகப் பொருந்தும். அனைத்து நுண் துகள்களின் அலை பண்புகள்.
B).ஒளி அலை மற்றும் கார்பஸ்குலர் பண்புகளைக் கொண்டுள்ளது. ஒளியின் பரவலின் போது அலை பண்புகள் தோன்றும் (குறுக்கீடு, மாறுபாடு). பொருளுடன் ஒளியின் தொடர்புகளின் போது கார்பஸ்குலர் பண்புகள் தோன்றும் (ஒளி மின் விளைவு, உமிழ்வு மற்றும் அணுக்களால் ஒளியை உறிஞ்சுதல்).
ஃபோட்டானின் துகள்களின் பண்புகள் (ஆற்றல் ஈமற்றும் வேகம் ப) உறவுகளால் அதன் அலை பண்புகளுடன் (அதிர்வெண் ν மற்றும் அலைநீளம் λ) தொடர்புடையது
எங்கே ம= 6.63·10 –34 J·s - பிளாங்கின் மாறிலி.
பிரஞ்சு இயற்பியலாளர் டி ப்ரோக்லி 1924 இல் அலை மற்றும் கார்பஸ்குலர் பண்புகளின் கலவையானது ஒளியில் மட்டுமல்ல, எந்தவொரு பொருள் உடலிலும் உள்ளார்ந்ததாக உள்ளது என்று பரிந்துரைத்தார். டி ப்ரோக்லியின் கூற்றுப்படி, ஒவ்வொரு உடலும் ஒரு நிறை கொண்டது மீ, வேகம் v உடன் நகரும், அலைநீளம் கொண்ட அலை செயல்முறைக்கு ஒத்திருக்கிறது
(தொடர்பற்ற தோராயமான υ<< c).
அடிப்படைத் துகள்களில் அலை பண்புகள் மிகத் தெளிவாக வெளிப்படுகின்றன. இது நிகழ்கிறது, ஏனெனில் துகள்களின் சிறிய நிறை காரணமாக, அலைநீளம் படிக லட்டுகளில் உள்ள அணுக்களுக்கு இடையிலான தூரத்துடன் ஒப்பிடப்படுகிறது. இந்த வழக்கில், துகள்களின் கற்றை ஒரு படிக லட்டியுடன் தொடர்பு கொள்ளும்போது, விரிமாற்றம் ஏற்படுகிறது.
துகள்களின் அலை பண்புகளை விளக்குவதற்கு, ஒரு சிந்தனை சோதனை பெரும்பாலும் பயன்படுத்தப்படுகிறது - எலக்ட்ரான்களின் (அல்லது பிற துகள்கள்) ஒரு பீம் அகலம் Δ ஒரு பிளவு வழியாக செல்கிறது. x. அலைக் கோட்பாட்டின் பார்வையில், ஒரு பிளவு மூலம் மாறுபாட்டின் போது, கற்றை ஒரு கோண வேறுபாட்டுடன் விரிவடையும் θ ≥ λ / Δ x. ஒரு கார்பஸ்குலர் பார்வையில், பிளவு வழியாக சென்ற பிறகு கற்றை விரிவடைவது துகள்களில் ஒரு குறிப்பிட்ட குறுக்கு உந்தத்தின் தோற்றத்தால் விளக்கப்படுகிறது. இந்த குறுக்கு வேகத்தின் மதிப்புகளின் பரவல் ("நிச்சயமற்ற தன்மை").
விகிதம்
நிச்சயமற்ற உறவு என்று அழைக்கப்படுகிறது. கார்பஸ்குலர் மொழியில் இந்த உறவு துகள்களில் அலை பண்புகள் இருப்பதை வெளிப்படுத்துகிறது.
இரண்டு நெருங்கிய இடைவெளியில் உள்ள பிளவுகள் வழியாக எலக்ட்ரான்களின் கற்றை கடந்து செல்வதை உள்ளடக்கிய ஒரு பரிசோதனையானது துகள்களின் அலை பண்புகளின் இன்னும் குறிப்பிடத்தக்க விளக்கமாக செயல்படும். இந்த பரிசோதனையானது யங்கின் ஆப்டிகல் குறுக்கீடு பரிசோதனையின் அனலாக் ஆகும்.
கணினி மாதிரியானது ஒன்று மற்றும் இரண்டு பிளவுகள் மூலம் எலக்ட்ரான் டிஃப்ராஃப்ரக்ஷன் பற்றிய சிந்தனைப் பரிசோதனைகளை காட்சித் திரையில் மீண்டும் உருவாக்குகிறது.
பிளவுகளுடன் கூடிய திரையை அணுகும் போது, துகள்கள் டி ப்ரோக்லி அலைகளைப் போல அதனுடன் தொடர்பு கொள்கின்றன. குவாண்டம் இயற்பியலில் Ψ செயல்பாடுகளைப் பயன்படுத்தி பிளவுகள் கொண்ட திரை மற்றும் புகைப்படத் தட்டுக்கு இடையே உள்ள இடைவெளியில் துகள்களின் நடத்தை விவரிக்கப்படுகிறது. psi செயல்பாட்டின் மாடுலஸின் சதுரம் ஒரு குறிப்பிட்ட இடத்தில் ஒரு துகள் கண்டறியும் நிகழ்தகவை தீர்மானிக்கிறது. இவ்வாறு, ஒரு புகைப்படத் தட்டில் பல்வேறு புள்ளிகளில் துகள்களின் வருகை ஒரு நிகழ்தகவு செயல்முறை ஆகும். இந்த செயல்முறையை நிரூபிக்க கணினி மாதிரி உங்களை அனுமதிக்கிறது.
ஒற்றைப் பிளவின் விஷயத்தில், துகள்களின் இரட்டைத் தன்மையின் விளைவாக நிச்சயமற்ற உறவை மாதிரி விளக்குகிறது. நீங்கள் குறிப்பிட்ட வரம்புகளுக்குள் பிளவின் அகலத்தை மாற்றலாம் மற்றும் புகைப்படத் தட்டில் எலக்ட்ரான் கற்றையின் டிஃப்ராஃப்ரக்ஷன் மங்கலாவதைக் காணலாம்.
எலக்ட்ரான்கள் 100 eV வரிசையின் ஆற்றலைக் கொண்டிருப்பதாகக் கருதப்படுகிறது.
இரண்டு பிளவுகளின் விஷயத்தில், புகைப்படத் தட்டில் காணப்பட்ட விநியோகமானது, ஒவ்வொரு பிளவுகளிலிருந்தும் தனித்தனியாக இரண்டு சுயாதீன விநியோகங்களின் எளிய சூப்பர்போசிஷன் அல்ல என்பதை நினைவில் கொள்ளவும். புகைப்படத் தட்டில் குறுக்கீடு விளிம்புகளின் தோற்றம், புகைப்படத் தகட்டை அடைந்த ஒவ்வொரு துகளும் ஒரே நேரத்தில் திரையின் இரு பிளவுகள் வழியாகச் சென்றதை தெளிவாகக் குறிக்கிறது.
64.ஹைசன்பெர்க் நிச்சயமற்ற உறவு. 1927 இல், W. Heisenberg என்று அழைக்கப்படுவதைக் கண்டுபிடித்தார் , இதன்படி நிலை மற்றும் உந்தத்தின் நிச்சயமற்ற தன்மைகள் ஒன்றோடொன்று தொடர்புடையது: , எங்கே, மபிளாங்க் நிலையானது. மைக்ரோவேர்ல்டின் விளக்கத்தின் தனித்தன்மை என்னவென்றால், Δx நிலையின் நிச்சயமற்ற தன்மையின் (தீர்மானத்தின் துல்லியம்) மற்றும் உந்தத்தின் Δp x இன் நிச்சயமற்ற தன்மையின் (தீர்மானத்தின் துல்லியம்) எப்போதும் சமமாகவோ அல்லது அதிகமாகவோ இருக்க வேண்டும் - . இதிலிருந்து இந்த அளவுகளில் ஒன்றில் குறைவு மற்றொன்றின் அதிகரிப்புக்கு வழிவகுக்கும். எந்தவொரு அளவீடும் சில பிழைகளுடன் தொடர்புடையது என்பது அனைவரும் அறிந்ததே, மேலும் அளவீட்டு கருவிகளை மேம்படுத்துவதன் மூலம், பிழைகளை குறைக்க முடியும், அதாவது, அளவீட்டு துல்லியத்தை அதிகரிக்க முடியும். ஆனால் ஹைசன்பெர்க் ஒரு நுண் துகள்களின் ஒருங்கிணைந்த (கூடுதல்) குணாதிசயங்கள் இருப்பதைக் காட்டினார், அதன் சரியான ஒரே நேரத்தில் அளவீடு அடிப்படையில் சாத்தியமற்றது. அந்த. நிச்சயமற்ற தன்மை என்பது மாநிலத்தின் ஒரு சொத்து; இது சாதனத்தின் துல்லியத்துடன் தொடர்புடையது அல்ல.
மற்ற இணை அளவுகளுக்கு - ஆற்றல் E மற்றும் நேரம் டி நிச்சயமற்ற உறவுகள், வடிவம் உள்ளது: . இதன் பொருள் Δ அமைப்பின் சிறப்பியல்பு பரிணாம நேரத்தில் டி, அதன் ஆற்றலை நிர்ணயிப்பதில் பிழை குறைவாக இருக்க முடியாது. இந்த உறவிலிருந்து, அழைக்கப்படுபவற்றிலிருந்து வெளிப்படுவதற்கான சாத்தியக்கூறு பின்வருமாறு மெய்நிகர் துகள்கள்ஆற்றல் கொண்டவர்களை விட குறைவான காலத்திற்கு ஈ. இந்த வழக்கில், ஆற்றல் பாதுகாப்பு சட்டம் மீறப்படாது. எனவே, நவீன யோசனைகளின்படி வெற்றிடம்இது புலங்கள் மற்றும் துகள்கள் இல்லாத வெற்றிடமல்ல, மாறாக மெய்நிகர் துகள்கள் தொடர்ந்து தோன்றும் மற்றும் மறைந்துவிடும் ஒரு இயற்பியல் பொருள்.
குவாண்டம் இயக்கவியலின் அடிப்படைக் கோட்பாடுகளில் ஒன்று நிச்சயமற்ற கொள்கை, ஹைசன்பெர்க் கண்டுபிடித்தார். ஒரு நுண்ணிய பொருளை விவரிக்கும் சில அளவுகள் பற்றிய தகவலைப் பெறுவது தவிர்க்க முடியாமல் மற்ற அளவுகள் பற்றிய தகவல்களில் குறைவதற்கு வழிவகுக்கிறது, முதலாவதாக கூடுதலாக. நிச்சயமற்ற உறவுகளால் தொடர்புடைய அளவுகளை பதிவு செய்யும் கருவிகள் வெவ்வேறு வகைகளாக உள்ளன, அவை ஒருவருக்கொருவர் நிரப்புகின்றன. குவாண்டம் இயக்கவியலில் அளவீடு செய்வதன் மூலம், கிளாசிக்கல் மற்றும் குவாண்டம் பொருட்களுக்கு இடையேயான தொடர்புகளின் எந்தவொரு செயல்முறையையும், எந்தவொரு பார்வையாளருக்கும் கூடுதலாக மற்றும் சுயாதீனமாக நிகழும்.கிளாசிக்கல் இயற்பியலில் ஒரு அளவீடு பொருளைத் தொந்தரவு செய்யவில்லை என்றால், குவாண்டம் இயக்கவியலில் ஒவ்வொரு அளவீடும் பொருளை அழித்து, அதன் அலை செயல்பாட்டை அழிக்கிறது. ஒரு புதிய அளவீட்டிற்கு, பொருள் மீண்டும் தயாரிக்கப்பட வேண்டும். இது தொடர்பாக, என்.போர் முன்வைத்தார் நிரப்பு கொள்கை, இதன் சாராம்சம் என்னவென்றால், மைக்ரோவேர்ல்டின் பொருள்களின் முழுமையான விளக்கத்திற்கு இரண்டு எதிர், ஆனால் நிரப்பு, பிரதிநிதித்துவங்களைப் பயன்படுத்துவது அவசியம்.
நிச்சயமற்ற உறவின் விளக்கமாக ஃபோட்டான் டிஃப்ராஃப்ரக்ஷன்
குவாண்டம் கோட்பாட்டின் பார்வையில், ஒளியை ஒளி குவாண்டா - ஃபோட்டான்களின் நீரோட்டமாகக் கருதலாம். ஒரே வண்ணமுடைய விமான அலையானது ஒரு குறுகிய பிளவின் மீது மாறுபாட்டின் போது, பிளவு வழியாக செல்லும் ஒவ்வொரு ஃபோட்டானும் திரையில் ஒரு குறிப்பிட்ட புள்ளியைத் தாக்கும் (படம் 1.). ஃபோட்டான் எங்கு தாக்கும் என்பதை சரியாக கணிக்க முடியாது. இருப்பினும், மொத்தத்தில், ஃபோட்டான்கள் திரையில் வெவ்வேறு புள்ளிகளைத் தாக்கும் போது, அவை ஒரு டிஃப்ராஃப்ரக்ஷன் பேட்டர்னைக் கொடுக்கின்றன. ஒரு ஃபோட்டான் ஒரு பிளவு வழியாகச் செல்லும்போது, அதன் x ஒருங்கிணைப்பு Δx என்ற பிழையுடன் தீர்மானிக்கப்பட்டது என்று நாம் கூறலாம், இது பிளவின் அளவிற்கு சமம். ஒரு விமானத்தின் ஒரே வண்ணமுடைய அலையின் முன்புறம் ஒரு பிளவுடன் திரையின் விமானத்திற்கு இணையாக இருந்தால், ஒவ்வொரு ஃபோட்டானும் திரைக்கு செங்குத்தாக z அச்சில் இயக்கப்பட்ட ஒரு உந்தத்தைக் கொண்டுள்ளது. அலைநீளத்தை அறிந்து, இந்த துடிப்பை துல்லியமாக தீர்மானிக்க முடியும்: p = h/λ.
இருப்பினும், பிளவு வழியாகச் சென்ற பிறகு, துடிப்பின் திசை மாறுகிறது, இதன் விளைவாக ஒரு விலகல் முறை காணப்படுகிறது. ஒளியின் மாறுபாட்டின் போது அலைநீளம் மாறாது என்பதால், துடிப்பு மாடுலஸ் மாறாமல் இருக்கும். அசல் திசையில் இருந்து விலகல் x அச்சில் (படம் 1.) Δp x கூறுகளின் தோற்றத்தின் காரணமாக ஏற்படுகிறது. ஒவ்வொரு குறிப்பிட்ட ஃபோட்டானுக்கான இந்த கூறுகளின் மதிப்பை தீர்மானிக்க முடியாது, ஆனால் அதன் அதிகபட்ச முழுமையான மதிப்பு 2S டிஃப்ராஃப்ரக்ஷன் வடிவத்தின் அகலத்தை தீர்மானிக்கிறது. அதிகபட்ச மதிப்பு Δp x என்பது ஃபோட்டான் உந்தத்தின் நிச்சயமற்ற தன்மையின் அளவீடு ஆகும், இது ஒரு பிழை Δx உடன் அதன் ஒருங்கிணைப்புகளை தீர்மானிக்கும் போது எழுகிறது. படத்தில் இருந்து பார்க்க முடிந்தால், Δp x இன் அதிகபட்ச மதிப்பு இதற்கு சமம்: Δp x = psinθ, . என்றால் எல்>> கள் , பிறகு நாம் எழுதலாம்: sinθ =s/ எல்மற்றும் Δp x = p(s/ எல்).
போரின் கோட்பாட்டின் பற்றாக்குறையானது குவாண்டம் கோட்பாட்டின் அடித்தளங்களையும் நுண் துகள்களின் (எலக்ட்ரான்கள், புரோட்டான்கள், முதலியன) தன்மை பற்றிய கருத்துக்களையும் திருத்த வேண்டியதன் அவசியத்தை சுட்டிக்காட்டியது. சில ஆயங்கள் மற்றும் ஒரு குறிப்பிட்ட வேகத்தால் வகைப்படுத்தப்படும் ஒரு சிறிய இயந்திர துகள் வடிவில் எலக்ட்ரானின் பிரதிநிதித்துவம் எவ்வளவு விரிவானது என்பது பற்றிய கேள்வி எழுந்தது.
ஒளியின் தன்மை பற்றிய ஆழமான யோசனைகளின் விளைவாக, ஆப்டிகல் நிகழ்வுகளில் ஒரு வகையான இரட்டைத்தன்மை வெளிப்படுகிறது என்பது தெளிவாகியது. ஒளியின் இத்தகைய பண்புகளுடன், அதன் அலை இயல்பை (குறுக்கீடு, மாறுபாடு) நேரடியாகக் குறிக்கும் பிற பண்புகளும் உள்ளன, அதே போல் அதன் கார்பஸ்குலர் தன்மையை நேரடியாக வெளிப்படுத்துகின்றன (ஒளிமின்னழுத்த விளைவு, காம்ப்டன் நிகழ்வு).
1924 ஆம் ஆண்டில், லூயிஸ் டி ப்ரோக்லி ஒரு தைரியமான கருதுகோளை முன்வைத்தார், இரட்டைவாதம் என்பது ஆப்டிகல் நிகழ்வுகளின் ஒரு அம்சம் அல்ல, ஆனால் உலகளாவிய முக்கியத்துவத்தைக் கொண்டுள்ளது. "ஒளியியலில்," அவர் எழுதினார், "ஒரு நூற்றாண்டு காலமாக, அலையுடன் ஒப்பிடுகையில் கார்பஸ்குலர் தேர்வு முறை மிகவும் புறக்கணிக்கப்பட்டது; பொருளின் கோட்பாட்டில் நேர்மாறான தவறு செய்யப்படவில்லையா?" பொருளின் துகள்கள், கார்பஸ்குலர் பண்புகளுடன், அலை பண்புகளையும் கொண்டிருப்பதாகக் கருதி, டி ப்ரோக்லி, ஒளியின் விஷயத்தில் செல்லுபடியாகும் ஒரு படத்திலிருந்து மற்றொரு படத்திற்கு மாறுவதற்கான அதே விதிகளை பொருளின் துகள்களுக்கு மாற்றினார். ஒரு ஃபோட்டான் ஆற்றல் கொண்டது
மற்றும் உந்துதல்
டி ப்ரோக்லியின் யோசனையின்படி, ஒரு எலக்ட்ரான் அல்லது வேறு எந்த துகளின் இயக்கமும் அலை செயல்முறையுடன் தொடர்புடையது, அதன் அலைநீளம் சமம்
![]()
மற்றும் அதிர்வெண்
டி ப்ரோக்லியின் கருதுகோள் விரைவில் சோதனை ரீதியாக உறுதிப்படுத்தப்பட்டது. டேவிசன் மற்றும் ஜெர்மர் 1927 இல் க்யூபிக் அமைப்புக்கு சொந்தமான நிக்கல் ஒற்றை படிகத்திலிருந்து எலக்ட்ரான்களின் பிரதிபலிப்பு பற்றி ஆய்வு செய்தனர்.
மோனோஎனெர்ஜெடிக் எலக்ட்ரான்களின் ஒரு குறுகிய கற்றை ஒற்றை படிகத்தின் மேற்பரப்பில் செலுத்தப்பட்டது, இது படிகக் கலத்தின் பெரிய மூலைவிட்டத்திற்கு செங்குத்தாக தரையிறங்கியது (இந்த மேற்பரப்பிற்கு இணையான படிக விமானங்கள் குறியீடுகளால் (111) படிகவியலில் குறிக்கப்படுகின்றன; § 45 ஐப் பார்க்கவும்). பிரதிபலித்த எலக்ட்ரான்கள் கால்வனோமீட்டருடன் இணைக்கப்பட்ட உருளை மின்முனையால் சேகரிக்கப்பட்டன (படம் 18.1). கால்வனோமீட்டர் வழியாக பாயும் மின்னோட்டத்திலிருந்து பிரதிபலித்த கற்றைகளின் தீவிரம் மதிப்பிடப்பட்டது. எலக்ட்ரான் வேகம் மற்றும் கோணம் வேறுபட்டது. படத்தில். பல்வேறு எலக்ட்ரான் ஆற்றல்களில் உள்ள கோணத்தில் கால்வனோமீட்டரால் அளவிடப்படும் மின்னோட்டத்தின் சார்புநிலையை படம் 18.2 காட்டுகிறது.


வரைபடத்தில் உள்ள செங்குத்து அச்சு சம்பவ கற்றையின் திசையை தீர்மானிக்கிறது. கொடுக்கப்பட்ட திசையில் தற்போதைய வலிமையானது தோற்றத்திலிருந்து வளைவுடன் குறுக்குவெட்டு வரை வரையப்பட்ட ஒரு பிரிவின் நீளத்தால் குறிக்கப்படுகிறது. ஒரு குறிப்பிட்ட கோணத்தில் சிதறல் குறிப்பாக தீவிரமாக மாறியது, இந்த கோணம் அணு விமானங்களின் பிரதிபலிப்புடன் ஒத்துப்போகிறது, இதற்கு இடையேயான தூரம் d என்பது எக்ஸ்ரே ஆய்வுகளில் இருந்து அறியப்பட்டது. இந்த நேரத்தில், 54 V இன் முடுக்கி மின்னழுத்தத்தில் தற்போதைய வலிமை குறிப்பாக குறிப்பிடத்தக்கதாக மாறியது. இந்த மின்னழுத்தத்துடன் தொடர்புடைய அலைநீளம், சூத்திரத்தைப் பயன்படுத்தி கணக்கிடப்படுகிறது (18.1), 1.67 A க்கு சமம்.
ப்ராக் அலைநீளம் நிலைமையை திருப்திப்படுத்துகிறது
![]()
1.65 A க்கு சமமாக இருந்தது. டேவிசன் மற்றும் ஜெர்மரின் சோதனைகள் டி ப்ரோக்லியின் யோசனையின் சிறந்த உறுதிப்படுத்தலாக அங்கீகரிக்கப்பட வேண்டும் என்று தற்செயல் நிகழ்வு மிகவும் வியக்க வைக்கிறது.
ஜி.பி. தாம்சன் (1927) மற்றும் அவரைப் பொருட்படுத்தாமல், பி.எஸ். டார்டகோவ்ஸ்கி ஒரு எலக்ட்ரான் கற்றை உலோகத் தகடு வழியாகச் செல்லும் போது ஒரு மாறுபாடு வடிவத்தைப் பெற்றார். சோதனை பின்வருமாறு மேற்கொள்ளப்பட்டது (படம் 18.3). எலக்ட்ரான்களின் ஒரு கற்றை, பல பத்து கிலோவோல்ட் வரிசையின் சாத்தியமான வேறுபாட்டால் துரிதப்படுத்தப்பட்டது, ஒரு மெல்லிய உலோகத் தகடு வழியாகச் சென்று ஒரு புகைப்படத் தட்டில் விழுந்தது. ஒரு எலக்ட்ரான் ஒரு புகைப்படத் தகட்டைத் தாக்கும் போது, அது ஒரு ஃபோட்டானின் அதே விளைவைக் கொண்டிருக்கிறது. இந்த வழியில் பெறப்பட்ட தங்கத்தின் எலக்ட்ரான் டிஃப்ராஃப்ரக்ஷன் முறை (படம். 18.4, அ) இதே போன்ற நிலைமைகளின் கீழ் பெறப்பட்ட அலுமினியத்தின் எக்ஸ்ரே டிஃப்ராஃப்ரக்ஷன் வடிவத்துடன் ஒப்பிடப்படுகிறது (படம் 18.4, ஆ).


இரண்டு படங்களின் ஒற்றுமையும் வியக்க வைக்கிறது; மேலே உள்ள எல்லா நிகழ்வுகளிலும், டிஃப்ராஃப்ரக்ஷன் பேட்டர்ன். உறவால் நிர்ணயிக்கப்பட்ட அலைநீளத்திற்கு ஒத்திருக்கிறது (18.1).
டேவிசன் மற்றும் ஜெர்மர் ஆகியோரின் சோதனைகளிலும், தாம்சனின் சோதனைகளிலும், எலக்ட்ரான் கற்றைகளின் தீவிரம் மிகவும் அதிகமாக இருந்தது, ஒரே நேரத்தில் ஏராளமான எலக்ட்ரான்கள் படிகத்தின் வழியாக சென்றன. எனவே, இந்த செயல்பாட்டில் அதிக எண்ணிக்கையிலான எலக்ட்ரான்கள் ஒரே நேரத்தில் பங்கேற்பதன் காரணமாக கவனிக்கப்பட்ட டிஃப்ராஃப்ரக்ஷன் முறை ஏற்படுகிறது என்று கருதலாம், மேலும் படிகத்தின் வழியாக செல்லும் ஒரு தனிப்பட்ட எலக்ட்ரான் மாறுபாட்டைக் கண்டறியவில்லை. இந்த சிக்கலை தெளிவுபடுத்த, 1949 ஆம் ஆண்டில் சோவியத் இயற்பியலாளர்கள் எல்.எம்.பிபர்மேன், என்.ஜி. ஃபேப்ரிகாண்ட் ஆகியோர் எலக்ட்ரான் கற்றைகளின் தீவிரம் மிகவும் பலவீனமாக இருந்ததால், சாதனம் வழியாகச் சென்றது. படிகத்தின் வழியாக எலக்ட்ரான்களின் தொடர்ச்சியான இரண்டு பத்திகளுக்கு இடையிலான நேர இடைவெளி, முழு சாதனத்தின் வழியாக எலக்ட்ரான் பயணிக்கும் நேரத்தை விட தோராயமாக 30,000 மடங்கு அதிகமாகும். போதுமான வெளிப்பாட்டுடன், ஒரு டிஃப்ராஃப்ரக்ஷன் முறை பெறப்பட்டது, இது சாதாரண கற்றை தீவிரத்தில் காணப்பட்டதை விட வேறுபட்டதல்ல. எனவே, அலை பண்புகள் ஒரு தனிப்பட்ட எலக்ட்ரானில் உள்ளார்ந்தவை என்பது நிரூபிக்கப்பட்டது.
போரின் கோட்பாட்டின் பற்றாக்குறையானது குவாண்டம் கோட்பாட்டின் அடித்தளங்களையும், அடிப்படைத் துகள்களின் (எலக்ட்ரான்கள், புரோட்டான்கள், முதலியன) தன்மை பற்றிய கருத்துக்களையும் விமர்சன ரீதியாக மறுபரிசீலனை செய்ய வேண்டியதாயிற்று. சில ஆயங்கள் மற்றும் ஒரு குறிப்பிட்ட வேகத்தால் வகைப்படுத்தப்படும் ஒரு சிறிய இயந்திர துகள் வடிவத்தில் எலக்ட்ரானின் பிரதிநிதித்துவம் எவ்வளவு விரிவானது என்பது பற்றிய கேள்வி எழுந்தது.
ஒளியின் தன்மை பற்றிய நமது அறிவை ஆழப்படுத்தியதன் விளைவாக, ஆப்டிகல் நிகழ்வுகளில் ஒரு வகையான இருமைத்தன்மை வெளிப்படுகிறது என்பது தெளிவாகியது (பார்க்க § 57). ஒளியின் இத்தகைய பண்புகளுடன், அதன் அலை இயல்பை (குறுக்கீடு, மாறுபாடு) நேரடியாகக் குறிக்கும் பிற பண்புகளும் உள்ளன, அதே போல் அதன் கார்பஸ்குலர் தன்மையை நேரடியாக வெளிப்படுத்துகின்றன (ஒளிமின்னழுத்த விளைவு, காம்ப்டன் நிகழ்வு).
1924 ஆம் ஆண்டில், லூயிஸ் டி ப்ரோக்லி ஒரு தைரியமான கருதுகோளை முன்வைத்தார், இருமை என்பது ஆப்டிகல் நிகழ்வுகளின் ஒரு அம்சம் அல்ல, ஆனால் உலகளாவிய முக்கியத்துவத்தைக் கொண்டுள்ளது. "ஒளியியலில்," அவர் எழுதினார், "ஒரு நூற்றாண்டு காலமாக, அலையுடன் ஒப்பிடுகையில் கார்பஸ்குலர் தேர்வு முறை மிகவும் புறக்கணிக்கப்பட்டது; பொருளின் கோட்பாட்டில் எதிர் தவறு செய்யப்படவில்லையா?"
பொருளின் துகள்கள், கார்பஸ்குலர் பண்புகளுடன், அலை பண்புகளையும் கொண்டிருப்பதாகக் கருதி, டி ப்ரோக்லி அதே மொழிபெயர்ப்பு விதிகளை பொருளின் துகள்களுக்கு மாற்றினார்.
ஒரு படத்திலிருந்து இன்னொரு படத்திற்கு மாறுதல், இது ஒளியின் விஷயத்தில் உண்மை. ஃபோட்டான், அறியப்படுகிறது [பார்க்க. சூத்திரங்கள் (57.1) மற்றும் (57.4)], ஆற்றல் கொண்டது
மற்றும் உந்துதல்
டி ப்ரோக்லியின் யோசனையின்படி, ஒரு எலக்ட்ரான் அல்லது வேறு எந்த துகளின் இயக்கமும் அலை செயல்முறையுடன் தொடர்புடையது, அதன் அலைநீளம் சமம்
மற்றும் அதிர்வெண்
டி ப்ரோக்லியின் கருதுகோள் விரைவில் சோதனை ரீதியாக அற்புதமாக உறுதிப்படுத்தப்பட்டது. டேவிசன் மற்றும் ஜெர்மர் ஒரு படிகத் தட்டில் இருந்து சிதறிய எலக்ட்ரான்களின் கற்றை ஒரு மாறுபாடு வடிவத்தை உருவாக்குகிறது என்பதைக் கண்டுபிடித்தனர். தாம்சன் மற்றும், சுயாதீனமாக, டார்டகோவ்ஸ்கி ஒரு எலக்ட்ரான் கற்றை உலோகத் தகடு வழியாகச் செல்லும் போது ஒரு மாறுபாடு வடிவத்தைப் பெற்றார். சோதனை பின்வருமாறு மேற்கொள்ளப்பட்டது (படம் 190). எலக்ட்ரான்களின் ஒரு கற்றை, பல பத்து கிலோவோல்ட் வரிசையின் சாத்தியமான வேறுபாட்டால் துரிதப்படுத்தப்பட்டது, ஒரு மெல்லிய உலோகத் தகடு வழியாகச் சென்று ஒரு புகைப்படத் தட்டில் விழுந்தது. ஒரு எலக்ட்ரான் ஒரு புகைப்படத் தகட்டைத் தாக்கும் போது, அது ஒரு ஃபோட்டானின் அதே விளைவைக் கொண்டிருக்கிறது. இந்த வழியில் பெறப்பட்ட தங்கத்தின் எலக்ட்ரான் டிஃப்ராஃப்ரக்ஷன் முறை (படம் 191, A)இதேபோன்ற நிலைமைகளின் கீழ் பெறப்பட்ட அலுமினியத்தின் எக்ஸ்ரே டிஃப்ராஃப்ரக்ஷன் வடிவத்துடன் ஒப்பிடும்போது (படம் 191.6). இரண்டு ஓவியங்களுக்கிடையிலான ஒற்றுமைகள் குறிப்பிடத்தக்கவை.
அணு மற்றும் மூலக்கூறு கற்றைகளிலும் டிஃப்ராஃப்ரக்ஷன் நிகழ்வுகள் காணப்படுகின்றன என்பதை ஸ்டெர்னும் அவரது சக ஊழியர்களும் காட்டினர். மேலே உள்ள எல்லா நிகழ்வுகளிலும்


டிஃப்ராஃப்ரக்ஷன் பேட்டர்ன் ரிலேஷன் (64.1) மூலம் நிர்ணயிக்கப்பட்ட அலைநீளத்திற்கு ஒத்திருக்கிறது.
விவரிக்கப்பட்ட சோதனைகளில் இருந்து, ஒரு குறிப்பிட்ட வேகத்தின் நுண் துகள்களின் கற்றை மற்றும்

■கட்டுப்பாடு ஒரு விமான அலையிலிருந்து பெறப்பட்ட மாதிரியைப் போன்ற ஒரு மாறுபாடு வடிவத்தை அளிக்கிறது.
எலக்ட்ரான் டிஃப்ராஃப்ரக்ஷன் - சிதறல் செயல்முறை எலக்ட்ரான்கள்எலக்ட்ரான் வெளிப்படுத்தும் ஒரு பொருளின் துகள்களின் தொகுப்பில் அலைபண்புகள். இந்த நிகழ்வு அழைக்கப்படுகிறது அலை-துகள் இருமை, பொருளின் ஒரு துகள் (இந்த விஷயத்தில், தொடர்பு கொள்ளும் எலக்ட்ரான்கள்) ஒரு அலை என்று விவரிக்கப்படலாம்.
நியூட்ரான் டிஃப்ராக்ஷன்- நியூட்ரான் சிதறலின் நிகழ்வு, இதில் நியூட்ரானின் அலை பண்புகள் தீர்க்கமான பாத்திரத்தை வகிக்கின்றன (பார்க்க. அலை-துகள் இருமை).அலைநீளம் மற்றும் வேகம் ஆர்டி ப்ரோக்லியின் உறவுடன் தொடர்புடையது =hp. கணிதம். D. n. இன் விளக்கம், அதே போல் மற்ற அலை புலங்களின் விஷயத்தில் இருந்து பின்வருமாறு ஹைஜென்ஸ்-ஃப்ரெஸ்னல் கொள்கைமற்றும், இந்த அர்த்தத்தில், விளக்கம் போன்றது ஒளி விலகல், எக்ஸ்ரே கதிர்கள், எலக்ட்ரான்கள் மற்றும் பிற நுண் துகள்கள் (பார்க்க. அலை மாறுபாடு).இந்த விளக்கத்தின்படி, சிதறியவற்றின் தீவிரம் கதிர்வீச்சுவிண்வெளியில் ஒரு குறிப்பிட்ட புள்ளியில் சிதறும் பொருளின் பண்புகள் மற்றும் பண்புகள் இரண்டையும் சார்ந்துள்ளது. அதன்படி, டி.என். நியூட்ரான் கற்றைகளை (நியூட்ரான் மோனோக்ரோமேட்டர்கள், பகுப்பாய்விகள்) படிப்பதற்கு அல்லது உருவாக்குவதற்கும், சிதறல் பொருளின் கட்டமைப்பை ஆய்வு செய்வதற்கும் பயன்படுத்தப்படுகிறது.

அரிசி. 1. Sn கருவில் சிதறிய 14 MeV ஆற்றல் கொண்ட நியூட்ரான்களின் கோணப் பரவல்; - சிதறல் குறுக்கு வெட்டு; - சிதறல் கோணம்.
ஆஸிலேட்டரின் பூஜ்ஜிய-புள்ளி ஆற்றலின் மதிப்பீடு. முந்தைய எடுத்துக்காட்டில் இருந்ததைப் போலவே நாங்கள் செயல்படுவோம். கிளாசிக்கல் ஒரு பரிமாண ஹார்மோனிக் ஆஸிலேட்டரின் ஆற்றல் வெளிப்பாடு மூலம் விவரிக்கப்படுகிறது
E = px2 / 2m + mω2x2 / 2.
ஒரு ஊசலாடும் நுண்ணிய பொருளின் உந்தம் மற்றும் ஒருங்கிணைப்புகளின் நிச்சயமற்ற தன்மைகளாக px மற்றும் x ஆகியவற்றைக் கருத்தில் கொண்டு சமத்துவம் pxх = h ஐ நிச்சயமற்ற உறவாகப் பயன்படுத்தினால், நாம் பெறுகிறோம்
E(px) = px2 / 2m + mω2h2 / 2px2.
வழித்தோன்றலை பூஜ்ஜியத்திற்கு சமன் செய்து, அளவைக் காண்கிறோம்
p0 = mωh, இதில் செயல்பாடு E(px) குறைந்தபட்ச மதிப்பை எடுக்கும். இந்த மதிப்பு சமமாக உள்ளதா என்பதைச் சரிபார்ப்பது எளிது
E = E(p0) = hω.
இந்த முடிவு மிகவும் சுவாரஸ்யமானது. குவாண்டம் இயக்கவியலில் ஆஸிலேட்டர் ஆற்றல் மறைய முடியாது என்பதை இது காட்டுகிறது; அதன் குறைந்தபட்ச மதிப்பு hω வரிசையாக மாறிவிடும். இது பூஜ்ஜிய புள்ளி ஆற்றல் என்று அழைக்கப்படுகிறது.
பூஜ்ஜிய-புள்ளி அலைவுகளின் இருப்பை கணக்கில் எடுத்துக்கொள்வது, குறிப்பாக, பின்வரும் சுவாரஸ்யமான முடிவுக்கு வரலாம்: ஒரு படிகத்தின் அணுக்களின் அதிர்வு இயக்கத்தின் ஆற்றல் முழுமையான பூஜ்ஜியத்தின் வெப்பநிலையில் கூட பூஜ்ஜியத்திற்கு செல்லாது.
பூஜ்ஜிய அலைவுகள் ஒரு அடிப்படை பொதுவான சூழ்நிலையை விளக்குகின்றன: "ஒரு சாத்தியமான கிணற்றின் அடிப்பகுதியில்" ஒரு நுண்ணிய பொருளை உணர இயலாது அல்லது வேறுவிதமாகக் கூறினால், "ஒரு நுண்ணிய பொருள் சாத்தியமான கிணற்றின் அடிப்பகுதியில் விழ முடியாது." இந்த முடிவு, உந்த நிச்சயமற்ற உறவுகளின் நேரடி விளைவு என்பதால், சாத்தியமான கிணற்றின் வகையைச் சார்ந்தது அல்ல; இந்த வழக்கில், ஒருங்கிணைப்பின் நிச்சயமற்ற தன்மை தன்னிச்சையாக பெரியதாக மாற வேண்டும், இது நுண்ணிய பொருள் சாத்தியமான கிணற்றில் உள்ளது என்ற உண்மைக்கு முரணானது.
சாத்தியமான தடையின் மூலம் எலக்ட்ரான் டன்னலிங் என்பது ஒரு அடிப்படையான குவாண்டம் இயந்திர விளைவு ஆகும், இது கிளாசிக்கல் மெக்கானிக்ஸில் ஒப்புமை இல்லை. சுரங்கப்பாதை விளைவு என்பது குவாண்டம் இயக்கவியலின் அடிப்படை தொடக்க புள்ளிகளில் ஒன்றின் சோதனை உறுதிப்படுத்தல் ஆகும் - அடிப்படை துகள்களின் பண்புகளின் அலை-துகள் இருமை.
சுரங்கப்பாதை விளைவு என்பது ஒரு எலக்ட்ரான் போன்ற ஒரு அடிப்படைத் துகள், துகள்களின் மொத்த ஆற்றலை விட தடை அதிகமாக இருக்கும்போது, சாத்தியமான தடையின் வழியாக (சுரங்கம்) கடந்து செல்லும் திறன் ஆகும். நமது நூற்றாண்டின் 20-30 களில் குவாண்டம் இயக்கவியலின் உருவாக்கத்தின் போது இயற்பியலாளர்களால் நுண்ணியத்தில் ஒரு சுரங்கப்பாதை விளைவு இருப்பதற்கான சாத்தியக்கூறுகள் புரிந்து கொள்ளப்பட்டன. பின்னர், சுரங்கப்பாதை விளைவு காரணமாக, இயற்பியலின் பல்வேறு துறைகளில் சோதனை முறையில் கண்டுபிடிக்கப்பட்ட சில மிக முக்கியமான நிகழ்வுகள் விளக்கப்பட்டன.
கேள்வி 12
அணு (இருந்து பழைய கிரேக்கம்ἄτομος - பிரிக்க முடியாதது) - நுண்ணிய அளவு மற்றும் நிறை கொண்ட ஒரு பொருளின் ஒரு துகள், சிறிய பகுதி இரசாயன உறுப்பு, இது அதன் பண்புகளை தாங்கி நிற்கிறது.
ஒரு அணுவால் ஆனது அணுக்கருமற்றும் எலக்ட்ரான்கள். கருவில் உள்ள புரோட்டான்களின் எண்ணிக்கை எலக்ட்ரான்களின் எண்ணிக்கையுடன் ஒத்துப்போனால், அணு முழுவதும் மின் நடுநிலையாக மாறும். இல்லையெனில் அது சில நேர்மறை அல்லது எதிர்மறை மின்னூட்டத்தைக் கொண்டுள்ளது மற்றும் அழைக்கப்படுகிறது அயனி. சில சந்தர்ப்பங்களில், அணுக்கள் மின்சார நடுநிலை அமைப்புகளாக மட்டுமே புரிந்து கொள்ளப்படுகின்றன, இதில் அணுக்கருவின் கட்டணம் எலக்ட்ரான்களின் மொத்த கட்டணத்திற்கு சமமாக இருக்கும், இதனால் அவை மின்சாரம் சார்ஜ் செய்யப்பட்ட அயனிகளுடன் வேறுபடுகின்றன.
அணுவின் கிட்டத்தட்ட முழு (99.9% க்கும் அதிகமான) வெகுஜனத்தை சுமந்து செல்லும் கரு, நேர்மறையாக கொண்டுள்ளது சார்ஜ் செய்யப்பட்ட புரோட்டான்கள்மற்றும் கட்டணம் விதிக்கப்படாதது நியூட்ரான்கள், பயன்படுத்தி ஒன்றோடொன்று இணைக்கப்பட்டுள்ளது வலுவான தொடர்பு. அணுக்கருவில் உள்ள புரோட்டான்கள் மற்றும் நியூட்ரான்களின் எண்ணிக்கையைப் பொறுத்து அணுக்கள் வகைப்படுத்தப்படுகின்றன: புரோட்டான்களின் எண்ணிக்கை Z என்பது அணு எண்ணுடன் ஒத்துள்ளது. கால அட்டவணையில்மற்றும் அது ஒரு குறிப்பிட்ட வேதியியல் உறுப்புக்கு சொந்தமானது என்பதை தீர்மானிக்கிறது, மேலும் நியூட்ரான்களின் எண்ணிக்கை N - ஒரு குறிப்பிட்டது ஐசோடோப்புஇந்த உறுப்பு. Z எண் மொத்த நேர்மறை மின் கட்டணத்தையும் தீர்மானிக்கிறது (Z இ) அணுக்கரு மற்றும் நடுநிலை அணுவில் உள்ள எலக்ட்ரான்களின் எண்ணிக்கை, அதன் அளவை தீர்மானிக்கிறது.
ஹைட்ரஜன் போன்ற அணுக்கள்- அணுக்கள் (அயனிகள்), ஒரு ஹைட்ரஜன் அணுவைப் போல, ஒரு கரு மற்றும் ஒரு எலக்ட்ரானின். at கொண்ட தனிமங்களின் அயனிகள் இதில் அடங்கும். எண் 2, ஒன்றைத் தவிர அனைத்து எலக்ட்ரான்களையும் இழந்துவிட்டது: He +, Li +2, B+ 3,. . . ஹைட்ரஜனுடன் சேர்ந்து அவை எளிமையானவை ஐசோ எலக்ட்ரானிக் தொடர்.ஆற்றல் நிலைகள் (மற்றும் நிறமாலை) V. a. ஹைட்ரஜனைப் போன்றது, Z 2 காரணி மூலம் மாற்றங்களின் ஆற்றல்களின் (மற்றும் அதிர்வெண்கள்) அவற்றிலிருந்து வேறுபடுகிறது (பார்க்க. அணு).
வி மீசோஅட்டம்), அதே போல் எலக்ட்ரான் மற்றும் பாசிட்ரான் ( பாசிட்ரோனியம்; ) இந்த அமைப்புகளுக்கு ஆற்றல் நிலைகள் மற்றும் ஹைட்ரஜனைப் போன்ற நிறமாலைகளும் பெறப்படுகின்றன.
ஆற்றல் நிலை - ஈஜென் மதிப்புகள் குவாண்டம் அமைப்புகளின் ஆற்றல்கள், அதாவது, நுண் துகள்களைக் கொண்ட அமைப்புகள் ( எலக்ட்ரான்கள், புரோட்டான்கள்மற்றும் மற்றவர்கள் அடிப்படை துகள்கள்) மற்றும் சட்டங்களுக்கு உட்பட்டது குவாண்டம் இயக்கவியல். ஒவ்வொரு நிலை ஒரு குறிப்பிட்ட வகைப்படுத்தப்படும் அமைப்பின் நிலை, அல்லது வழக்கில் உள்ளவர்களின் துணைக்குழு சீரழிவு. கருத்து பொருந்தும் அணுக்கள்(மின்னணு நிலைகள்), மூலக்கூறுகள்(ஊசலாட்டங்கள் மற்றும் சுழற்சிகளுடன் தொடர்புடைய பல்வேறு நிலைகள்), அணுக்கருக்கள்(உள் அணு ஆற்றல் நிலைகள்) போன்றவை.
அயனியாக்கம் மற்றும் உற்சாகம்.
ஒரு எலக்ட்ரானை அணுக்கருவுடன் பிணைப்பிலிருந்து விடுவிப்பதற்கு, நேர்மறை அயனியை உருவாக்குவதற்கு, ஒரு குறிப்பிட்ட அளவு ஆற்றலைச் செலவிடுவது அவசியம். எலக்ட்ரானை அகற்ற செலவிடப்படும் ஆற்றல் அழைக்கப்படுகிறது அயனியாக்கம் வேலை.எலக்ட்ரான் வோல்ட்களில் வெளிப்படுத்தப்படும் அயனியாக்கத்தின் வேலை அழைக்கப்படுகிறது அயனியாக்கம் சாத்தியம்(எலக்ட்ரான்வோல்ட் என்பது 1 V இன் சாத்தியமான வேறுபாட்டுடன் மின்சார புலத்தால் துரிதப்படுத்தப்பட்ட எலக்ட்ரானால் பெறப்பட்ட ஆற்றல் அலகு ஆகும்). ஒரு வாயு மூலக்கூறு அல்லது அணுவின் பிணைக்கப்பட்ட எலக்ட்ரானுக்கு நீங்கள் ஒரு குறிப்பிட்ட அளவு கூடுதல் ஆற்றலை வழங்கினால், எலக்ட்ரான் அதிக ஆற்றல் மட்டத்துடன் ஒரு புதிய சுற்றுப்பாதைக்கு நகரும், மேலும் மூலக்கூறு அல்லது அணு உற்சாகமான நிலையில் இருக்கும். எலக்ட்ரான் வோல்ட்களில் வெளிப்படுத்தப்படும் ஆற்றலின் அளவு, ஒரு வாயுவின் அணு அல்லது மூலக்கூறை தூண்டுவதற்கு செலவிடப்பட வேண்டும் தூண்டுதல் திறன்.ஒரு வாயுவின் அணு அல்லது மூலக்கூறின் உற்சாகமான நிலை நிலையற்றது, மேலும் எலக்ட்ரான் மீண்டும் ஒரு நிலையான சுற்றுப்பாதைக்குத் திரும்பலாம், மேலும் அணு அல்லது மூலக்கூறு சாதாரண உற்சாகமில்லாத நிலைக்குச் செல்லும். தூண்டுதல் ஆற்றல் ஒளி மின்காந்த கதிர்வீச்சு வடிவத்தில் சுற்றியுள்ள இடத்திற்கு அனுப்பப்படுகிறது.
அயனியாக்கம் மற்றும் தூண்டுதல் திறனின் அளவு அணுவின் தன்மையைப் பொறுத்தது. குறைந்த அயனியாக்கம் சாத்தியம்
(3.9 eV) சீசியம் நீராவியைக் கொண்டுள்ளது, மேலும் ஹீலியம் வாயுவில் அதிக அளவு (24.5 eV) காணப்படுகிறது. அல்கலைன் பூமி உலோகங்கள் (சீசியம், பொட்டாசியம், சோடியம், பேரியம், கால்சியம்) எலக்ட்ரான்களுக்கும் கருவுக்கும் இடையே பலவீனமான தொடர்பைக் கொண்டுள்ளன, எனவே அவை மிகக் குறைந்த அயனியாக்கம் திறன்களைக் கொண்டுள்ளன, எனவே, இரும்பை விட எலக்ட்ரானின் செயல்பாட்டைத் தூண்டுவதற்கும் வேலை செய்வதற்கும் குறைந்த ஆற்றல் தேவைப்படும். மாங்கனீசு, தாமிரம் மற்றும் நிக்கல். வெல்டிங் செய்யப்பட்ட உலோகத்தை விட குறைந்த அயனியாக்கம் மற்றும் தூண்டுதல் திறன்களைக் கொண்ட கூறுகள் வாயுக்களில் வில் வெளியேற்றத்தின் உறுதிப்படுத்தலை அதிகரிப்பதற்காக மின்முனை பூச்சுகளின் கலவையில் அறிமுகப்படுத்தப்படுகின்றன. ஒரு உலோகம் அல்லது திரவத்திலிருந்து எலக்ட்ரானை வெளியிடுவதற்கு தேவையான ஆற்றலின் அளவு அழைக்கப்படுகிறது எலக்ட்ரான் வேலை செயல்பாடுமற்றும் எலக்ட்ரான் வோல்ட்களில் வெளிப்படுத்தப்படுகிறது.
ஒரு ஹைட்ரஜன் அணுவில் ஒரு எலக்ட்ரானின் இடஞ்சார்ந்த விநியோகம். @
வரைபட ரீதியாக, எலக்ட்ரானைக் கண்டுபிடிப்பதற்கான நிகழ்தகவை மேகமாக சித்தரிக்கலாம், அங்கு இருண்ட பகுதிகள் கண்டுபிடிப்பதற்கான அதிக நிகழ்தகவுடன் ஒத்திருக்கும். கொடுக்கப்பட்ட அணு நிலையில் எலக்ட்ரான் மேகத்தின் "அளவு" மற்றும் "வடிவம்" ஆகியவற்றைக் கணக்கிடலாம். ஹைட்ரஜன் அணுவின் தரை நிலைக்கு, ஷ்ரோடிங்கர் சமன்பாட்டைத் தீர்ப்பது கொடுக்கிறது  , (2.6)
, (2.6)
எங்கே φ
(ஆர்)அலைச் சார்பு என்பது அணுவின் மையத்திற்கு r தூரத்தை மட்டுமே சார்ந்துள்ளது, r 1 என்பது முதல் போர் சுற்றுப்பாதையின் ஆரத்துடன் ஒத்துப்போகும் மாறிலி. இதன் விளைவாக, ஹைட்ரஜனின் நில நிலையில் உள்ள எலக்ட்ரான் மேகம் படம் 11 இல் காட்டப்பட்டுள்ளபடி கோள சமச்சீராக உள்ளது. எலக்ட்ரான் மேகம் அணுவின் அளவையும் எலக்ட்ரானின் இயக்கத்தையும் தோராயமாக வகைப்படுத்துகிறது, ஏனெனில் (2.15) நிகழ்தகவு விண்வெளியில் எந்தப் புள்ளிக்கும் எலக்ட்ரான் பூஜ்ஜியமாக இருக்காது. படம் 12 ஹைட்ரஜன் அணுவின் எலக்ட்ரான் மேகங்களை மாநிலங்களில் காட்டுகிறது: n=2, l=1 மற்றும் m=1, 0, -1 காந்தப்புலத்தின் முன்னிலையில்.

அரிசி. 11. நில நிலையில் உள்ள ஹைட்ரஜன் அணுவின் எலக்ட்ரான் மேகம் n = 1, l = 0.

அரிசி. 12. ஹைட்ரஜன் அணுவின் எலக்ட்ரான் மேகங்கள் மற்றும் n = 2, l = 1 க்கு m = 1, 0, -1 நிலைகளில் கோண உந்தத்தின் முன்னோடி
இந்த நிலைகளில் அணுக்கருவிலிருந்து எலக்ட்ரானின் மிகவும் சாத்தியமான தூரத்தை நாம் தீர்மானித்தால், அவை தொடர்புடைய போர் சுற்றுப்பாதைகளின் ஆரங்களுக்கு சமமாக இருக்கும். எனவே, குவாண்டம் இயக்கவியல் சில பாதைகளில் எலக்ட்ரான் இயக்கத்தின் யோசனையைப் பயன்படுத்தவில்லை என்றாலும், இந்த கோட்பாட்டில் போர் சுற்றுப்பாதையின் ஆரங்கள் ஒரு குறிப்பிட்ட இயற்பியல் பொருளைக் கொடுக்கலாம்.
லெவல் அகலம்- ஆற்றல் குவாண்டம்-மெக்கானிக்கலின் நிச்சயமற்ற தன்மை. அமைப்பு (அணு, மூலக்கூறு போன்றவை) கண்டிப்பாக நிலையாக இல்லாத நிலையில் தனித்த ஆற்றல் நிலைகளைக் கொண்டுள்ளது. ஷ.உ. D, ஆற்றல் மட்டத்தின் மங்கலான தன்மை, அதன் விரிவாக்கம், cf ஐப் பொறுத்தது. கொடுக்கப்பட்ட நிலையில் கணினி தங்கியிருக்கும் காலம் - t இல் வாழ்நாள் கேமற்றும், படி நிச்சயமற்ற உறவுஆற்றல் மற்றும் நேரத்திற்கு, டி அமைப்பின் கண்டிப்பாக நிலையான நிலைக்கு கே= மற்றும் D =0. வாழ்நாள் டி கே, எனவே Sh.u. சாத்தியம் காரணமாக குவாண்டம் மாற்றங்கள்அமைப்புகள் மற்ற ஆற்றல்களுடன் மாநிலங்களாக. ஒரு இலவச அமைப்புக்கு (உதாரணமாக, தனிமைப்படுத்தப்பட்ட அணுவிற்கு) தன்னிச்சையான உமிழ்வுகள். ஒரு மட்டத்தில் இருந்து கீழ் நிலைக்கு மாறுவது கதிர்வீச்சு அல்லது இயற்கையான நிலையை தீர்மானிக்கிறது:
![]() , மட்டத்திலிருந்து தன்னிச்சையான உமிழ்வின் மொத்த நிகழ்தகவு எங்கே, அகி- ஐன்ஸ்டீன் குணகங்கள்தன்னிச்சையான உமிழ்வு. தன்னிச்சையான அல்லாத உமிழ்வுகளாலும் நிலை விரிவாக்கம் ஏற்படலாம். மாற்றங்கள், எடுத்துக்காட்டாக கதிரியக்கத்திற்கு. அணுக்கரு - ஆல்பா சிதைவு
.அணு மட்டத்தின் அகலம், மட்டத்தின் ஆற்றலுடன் ஒப்பிடும்போது மிகச் சிறியது. மற்ற சந்தர்ப்பங்களில் (உதாரணமாக, உற்சாகமான கருக்களுக்கு, குவாண்டம் மாற்றங்களின் நிகழ்தகவு நியூட்ரான்களின் உமிழ்வு காரணமாக உள்ளது மற்றும் மிக அதிகமாக உள்ளது) Sh.u. நிலைகளுக்கு இடையிலான தூரத்துடன் ஒப்பிடலாம். கணினி மற்ற மாநிலங்களுக்கு மாறுவதற்கான நிகழ்தகவை அதிகரிக்கும் எந்தவொரு தொடர்புகளும் கூடுதல் நிலைமைகளுக்கு வழிவகுக்கும். நிலைகளை விரிவுபடுத்துதல். ஒரு அணுவின் (அயனி) அளவுகளை விரிவுபடுத்துவது ஒரு எடுத்துக்காட்டு பிளாஸ்மாஅயனிகள் மற்றும் எலக்ட்ரான்களுடன் அதன் மோதலின் விளைவாக (பார்க்க. பிளாஸ்மா கதிர்வீச்சு)
. பொதுவாக, மொத்த ஷ.யூ. விகிதாசார இந்த நிலையிலிருந்து சாத்தியமான அனைத்து மாற்றங்களின் நிகழ்தகவுகளின் கூட்டுத்தொகை - தன்னிச்சையானது மற்றும் சிதைவினால் ஏற்படுகிறது. தொடர்புகள்.
, மட்டத்திலிருந்து தன்னிச்சையான உமிழ்வின் மொத்த நிகழ்தகவு எங்கே, அகி- ஐன்ஸ்டீன் குணகங்கள்தன்னிச்சையான உமிழ்வு. தன்னிச்சையான அல்லாத உமிழ்வுகளாலும் நிலை விரிவாக்கம் ஏற்படலாம். மாற்றங்கள், எடுத்துக்காட்டாக கதிரியக்கத்திற்கு. அணுக்கரு - ஆல்பா சிதைவு
.அணு மட்டத்தின் அகலம், மட்டத்தின் ஆற்றலுடன் ஒப்பிடும்போது மிகச் சிறியது. மற்ற சந்தர்ப்பங்களில் (உதாரணமாக, உற்சாகமான கருக்களுக்கு, குவாண்டம் மாற்றங்களின் நிகழ்தகவு நியூட்ரான்களின் உமிழ்வு காரணமாக உள்ளது மற்றும் மிக அதிகமாக உள்ளது) Sh.u. நிலைகளுக்கு இடையிலான தூரத்துடன் ஒப்பிடலாம். கணினி மற்ற மாநிலங்களுக்கு மாறுவதற்கான நிகழ்தகவை அதிகரிக்கும் எந்தவொரு தொடர்புகளும் கூடுதல் நிலைமைகளுக்கு வழிவகுக்கும். நிலைகளை விரிவுபடுத்துதல். ஒரு அணுவின் (அயனி) அளவுகளை விரிவுபடுத்துவது ஒரு எடுத்துக்காட்டு பிளாஸ்மாஅயனிகள் மற்றும் எலக்ட்ரான்களுடன் அதன் மோதலின் விளைவாக (பார்க்க. பிளாஸ்மா கதிர்வீச்சு)
. பொதுவாக, மொத்த ஷ.யூ. விகிதாசார இந்த நிலையிலிருந்து சாத்தியமான அனைத்து மாற்றங்களின் நிகழ்தகவுகளின் கூட்டுத்தொகை - தன்னிச்சையானது மற்றும் சிதைவினால் ஏற்படுகிறது. தொடர்புகள்.
சிக்கலான அணுக்களில் மின்னணு நிலைகளின் கட்டமைப்பின் அம்சங்கள். சுற்றுப்பாதைகளில் எலக்ட்ரான்களின் பரவலுக்கும் மெண்டலீவின் கால அட்டவணைக்கும் இடையிலான உறவு. @
வழக்கமாக, சாத்தியமான அனைத்து குவாண்டம் நிலைகளும் அடுக்குகள் (குண்டுகள்), துணை அடுக்குகள் (துணை ஓடுகள்) மற்றும் சுற்றுப்பாதைகளாக விநியோகிக்கப்படுகின்றன (தொகுக்கப்படுகின்றன). அது மாறியது போல், அணுக்களின் பண்புகள் இந்த நிலைகளில் எலக்ட்ரான்களின் விநியோகத்தால் தீர்மானிக்கப்படுகின்றன.
குவாண்டம் அடுக்கு (குவாண்டம் ஷெல்) என்பது குவாண்டம் எண் n இன் அதே மதிப்புக்கு ஒத்த நிலைகளின் தொகுப்பாகும், ஆனால் l, m, s இன் வெவ்வேறு மதிப்புகள். (2.8) இன் படி ஷெல்லில் இருக்கக்கூடிய மிகப்பெரிய எலக்ட்ரான்கள் N, அடுக்கு எண்ணின் இரு மடங்கு சதுரத்திற்கு சமம்: N=2n 2 . மல்டி எலக்ட்ரான் அணுவில் உள்ள நிலைகளின் ஆற்றல் இரண்டு குவாண்டம் எண்கள் n மற்றும் l ஐச் சார்ந்து இருப்பதால், குவாண்டம் அடுக்கில் உள்ள எலக்ட்ரான்கள் l ஆற்றல் நிலைகளை ஆக்கிரமிக்க முடியும். குவாண்டம் அடுக்குகள் அடுக்கு எண்களுடன் தொடர்புடைய எண்களால் குறிக்கப்படுகின்றன, கூடுதலாக, அவற்றுக்கு பெயர்கள் உள்ளன: அடுக்கு n = 1 என்பது K அடுக்கு (அல்லது K ஷெல்), அடுக்கு n = 2 என்பது L அடுக்கு (அல்லது L ஷெல்), அடுக்கு n = 3 என்பது M அடுக்கு என அழைக்கப்படுகிறது, n = 4 - N, n = 5 - O அடுக்கு, n = 6 - P மற்றும் பல.
n எண் கொண்ட ஒவ்வொரு குவாண்டம் அடுக்கும் n குவாண்டம் சப்லேயர்களை (சப்ஷெல்ஸ்) கொண்டிருக்கும், அதே n, l, ஆனால் வெவ்வேறு m, s கொண்ட ஒரு துணை அடுக்கு 2(2l+1 வரை இருக்கலாம் ) எலக்ட்ரான்கள், துணை அடுக்குகள் எழுத்துகளால் குறிக்கப்படுகின்றன: l = 0 – s, l= 1 – p, l= 2 – d, l= 3 – f, l= 4 – g, முதலியன. ஒரு துணை அடுக்கில் உள்ள எலக்ட்ரான்களின் ஆற்றல் தோராயமாக ஒரே மாதிரியாக இருக்கும்.
இதையொட்டி, ஒவ்வொரு துணை அடுக்கும் 2l+1 சுற்றுப்பாதைகளைக் கொண்டுள்ளது, அதே n, l, m, ஆனால் வெவ்வேறு s கொண்ட மாநிலங்களுடன் தொடர்புடையது. 1/2. ±ஒவ்வொரு சுற்றுப்பாதையிலும் வெவ்வேறு சுழல் எண்கள் கொண்ட இரண்டு எலக்ட்ரான்களுக்கு மேல் இருக்கக்கூடாது s =
எஸ்-சப்ளேயரில் அதிகபட்சம் 2 எலக்ட்ரான்கள் இருக்கலாம், பி-சப்ளேயர் - 6, டி - 10, எஃப் - 14, ஜி - 18 எலக்ட்ரான்கள். அதன்படி, K அடுக்கில் அதிகபட்சம் 2 எலக்ட்ரான்கள் இருக்கலாம், L அடுக்கு - 8, M அடுக்கு - 18, N அடுக்கு - 32, முதலியன.
1s® கட்டமைப்புகள் மற்றும் அடுக்குகளின் அதிகபட்ச நிரப்புதல்கள் சூத்திரங்களின் வடிவத்தில் சித்தரிக்கப்படுகின்றன: K-லேயர் 2 2s®, L அடுக்கு 2 2p 6 3s®, M- அடுக்கு 2 3p 6 3d 10 4s®, N- அடுக்கு 2 4p 6 4d 10 4f 14. அறிமுகப்படுத்தப்பட்ட கருத்துகளைப் பயன்படுத்தி, நீங்கள் வழக்கமாக ஒரு சூத்திரத்தைப் பயன்படுத்தலாம் மற்றும் எலக்ட்ரான்களின் விநியோகத்தை வரைபடமாக சித்தரிக்கலாம், எடுத்துக்காட்டாக, ஆக்ஸிஜன் அணு O 8, பின்வருமாறு: குறியீடாக - 1s 2 2s 2 2p 4, வரைபடமாக - (படம் 14).

படம் 14. ஆக்ஸிஜன் சுற்றுப்பாதைகளின் வழக்கமான வரைகலை பிரதிநிதித்துவம்.
சுற்றுப்பாதைகளை நிரப்பும்போது, எலக்ட்ரான்கள் முதலில் ஒவ்வொரு சுற்றுப்பாதையிலும் தனித்தனியாக அமைந்துள்ளன, பின்னர் அவை இரண்டாவது எலக்ட்ரான்களால் நிரப்பத் தொடங்குகின்றன. இந்த அம்சம் ஹண்டின் விதி என்று அழைக்கப்படுகிறது; படம் 14 ஆக்ஸிஜனுக்கு இந்த விதியின் பயன்பாட்டைக் காட்டுகிறது.
பாலி கொள்கை என்பது இயற்கையின் அடிப்படை விதியாகும், இதன் படி குவாண்டம் அமைப்பில் இரண்டு (அல்லது அதற்கு மேற்பட்ட) ஒரே மாதிரியான துகள்கள் அரை முழு எண் சுழலுடன் ஒரே நிலையில் இருக்க முடியாது. டபிள்யூ. பாலியால் (1925) உருவாக்கப்பட்டது.
ஒரு அணுவில் உள்ள ஒவ்வொரு எலக்ட்ரானின் நிலையும் நான்கு குவாண்டம் எண்களால் வகைப்படுத்தப்படுகிறது:
1. முதன்மை குவாண்டம் எண் n (n = 1, 2 ...).
2. சுற்றுப்பாதை (அசிமுதல்) குவாண்டம் எண் l (l = 0, 1, 2, ... n-1).
3. காந்த குவாண்டம் எண் m (m = 0, +/-1, +/-2, +/-... +/-l).
4. ஸ்பின் குவாண்டம் எண் ms (ms = +/-1/2).
முதன்மை குவாண்டம் எண் n இன் ஒரு நிலையான மதிப்புக்கு, எலக்ட்ரானின் 2n2 வெவ்வேறு குவாண்டம் நிலைகள் உள்ளன.
பாலி கொள்கை எனப்படும் குவாண்டம் இயக்கவியலின் விதிகளில் ஒன்று கூறுகிறது:
ஒரே அணுவில் ஒரே குவாண்டம் எண்களைக் கொண்ட இரண்டு எலக்ட்ரான்கள் இருக்க முடியாது (அதாவது, ஒரே நிலையில் இரண்டு எலக்ட்ரான்கள் இருக்க முடியாது).
பவுலி கொள்கையானது, அணுவின் பண்புகளை அவ்வப்போது திரும்பத் திரும்பச் சொல்வதற்கு ஒரு விளக்கத்தை அளிக்கிறது, அதாவது. மெண்டலீவின் தனிமங்களின் கால அமைப்பு.
போரின் முதல் போஸ்டுலேட் (நிலையான நிலைகளின் போஸ்டுலேட்) கூறுகிறது: ஒரு அணு அமைப்பு சிறப்பு நிலையான அல்லது குவாண்டம் நிலைகளில் மட்டுமே இருக்க முடியும், அவை ஒவ்வொன்றும் ஒரு குறிப்பிட்ட ஆற்றல் En. நிலையான நிலைகளில், அணு கதிர்வீச்சு இல்லை.
இந்த போஸ்டுலேட் கிளாசிக்கல் மெக்கானிக்ஸுடன் தெளிவான முரண்பாட்டில் உள்ளது, அதன்படி நகரும் எலக்ட்ரானின் ஆற்றல் ஏதேனும் இருக்கலாம். மின்காந்த அலைகளை வெளியிடாமல் எலக்ட்ரான்களின் வேகமான இயக்கத்தின் சாத்தியத்தை இது அனுமதிக்கிறது என்பதால், இது மின் இயக்கவியலுக்கும் முரண்படுகிறது. போரின் முதல் போஸ்டுலேட்டின் படி, ஒரு அணு ஒரு அமைப்பால் வகைப்படுத்தப்படுகிறது ஆற்றல் நிலைகள் , ஒவ்வொன்றும் ஒரு குறிப்பிட்ட நிலையான நிலைக்கு ஒத்திருக்கிறது (படம் 6.2.2). நேர்மறையாக சார்ஜ் செய்யப்பட்ட கருவைச் சுற்றி மூடிய பாதையில் நகரும் எலக்ட்ரானின் இயந்திர ஆற்றல் எதிர்மறையானது. எனவே, அனைத்து நிலையான நிலைகளும் ஆற்றல் மதிப்புகளுக்கு ஒத்திருக்கும் இ என் < 0. При இ என்≥ 0 எலக்ட்ரான் கருவில் இருந்து நகர்கிறது, அதாவது அயனியாக்கம் ஏற்படுகிறது. அளவு | ஈ 1 | அழைக்கப்பட்டது அயனியாக்கம் ஆற்றல் . ஆற்றல் நிலை ஈ 1 அழைக்கப்படுகிறது அடிப்படை நிலை அணு.
போரின் இரண்டாவது போஸ்டுலேட் (அதிர்வெண் விதி) பின்வருமாறு வடிவமைக்கப்பட்டுள்ளது: ஒரு அணு ஒரு நிலையான நிலையிலிருந்து E n ஆற்றலுடன் மற்றொரு நிலையான நிலைக்கு மாறும்போது, ஒரு குவாண்டம் உமிழப்படுகிறது அல்லது உறிஞ்சப்படுகிறது, இதன் ஆற்றல் வேறுபாடுக்கு சமம் நிலையான நிலைகளின் ஆற்றல்கள்:
போரின் இரண்டாவது கருத்தும் முரண்படுகிறது மேக்ஸ்வெல்லின் மின் இயக்கவியல், கதிர்வீச்சின் அதிர்வெண் அணுவின் ஆற்றலின் மாற்றத்தால் மட்டுமே தீர்மானிக்கப்படுகிறது மற்றும் எலக்ட்ரானின் இயக்கத்தின் தன்மையை எந்த வகையிலும் சார்ந்து இல்லை.
போரின் கோட்பாடு, அணு அமைப்புகளின் நடத்தையை விவரிக்கும் போது, பாரம்பரிய இயற்பியல் விதிகளை முழுமையாக நிராகரிக்கவில்லை. இது அணுக்கருவின் கூலம்ப் புலத்தில் எலக்ட்ரான்களின் சுற்றுப்பாதை இயக்கம் பற்றிய கருத்துக்களைப் பாதுகாத்தது. போரின் கோட்பாட்டில் உள்ள ரதர்ஃபோர்ட் அணுவின் கிளாசிக்கல் அணு மாதிரியானது எலக்ட்ரான் சுற்றுப்பாதைகளை அளவிடும் யோசனையால் கூடுதலாக வழங்கப்பட்டது. எனவே போரின் கோட்பாடு சில நேரங்களில் அழைக்கப்படுகிறது அரை கிளாசிக்கல் .
லைன் ஸ்பெக்ட்ரா - ஆப்டிகல் உமிழ்வு மற்றும் உறிஞ்சுதல் நிறமாலை, தனிப்பட்ட நிறமாலை கோடுகளைக் கொண்டது. எல்.எஸ். அணு நிறமாலை, நட்சத்திர வளிமண்டலங்களின் நிறமாலை (பார்க்க ஃபிரான்ஹோஃபர் கோடுகள்), கரிம நிறமாலை. சிறப்பு குறைந்த பேக்ஸ் வெப்பநிலையில் மூலக்கூறுகள். நிபந்தனைகள் (பார்க்க...
ATOMIC SPECTRA - இலவச ஆப்டிகல் ஸ்பெக்ட்ரா அல்லதுபலவீனமாக பிணைக்கப்பட்ட அணுக்கள் (மோனாடோமிக் வாயுக்கள், நீராவிகள்). அணுவின் குவாண்டம் மாற்றங்களால் ஏற்படுகிறது. அணு நிறமாலை என்பது ஒரு குறிப்பிட்ட நீளத்தால் வகைப்படுத்தப்படும் தனி நிறமாலைக் கோடுகளைக் கொண்ட வரி நிறமாலை ஆகும். அலைகள்மற்றும் எளிய அணுக்களுக்கு அவை தொகுக்கப்பட்டுள்ளன நிறமாலை தொடர். அவை அணுக்களின் கட்டமைப்பைப் பற்றிய தகவல்களைக் கொண்டிருக்கின்றன மற்றும் நிறமாலை பகுப்பாய்விலும் பயன்படுத்தப்படுகின்றன.
கேள்வி 13.
அணுக்கரு - புரோட்டான்கள் மற்றும் நியூட்ரான்கள் (நியூக்ளியோன்கள்) கொண்ட அணுவின் மையப் பாரிய பகுதி. யாவில் ஏ. அணுவின் முழு நிறை செறிவூட்டப்பட்டுள்ளது (99.95% க்கும் அதிகமாக). கருக்களின் பரிமாணங்கள் சுமார் 10 -13 -10 -12 செ.மீ மின்சார கட்டணம், ஏபிஎஸ் பல மடங்கு. எலக்ட்ரான் சார்ஜ் மதிப்பு e: Q = Ze. முழு எண் Z ஆனது உள்ள உறுப்புகளின் வரிசை எண்ணுடன் பொருந்துகிறது தனிமங்களின் கால அட்டவணை . யா. 1911 ஆம் ஆண்டில் ஈ. ரதர்ஃபோர்ட் என்பவரால் ஆல்பா துகள்கள் பொருளின் வழியாகச் செல்லும் போது சிதறுவது பற்றிய சோதனையில் கண்டுபிடிக்கப்பட்டது.
கட்டமைப்பு
அணுவின் மையப் பகுதி கரு. நேர்மறை மின் கட்டணம் மற்றும் அணுவின் வெகுஜனத்தின் பெரும்பகுதி அதில் குவிந்துள்ளது; எலக்ட்ரான் சுற்றுப்பாதைகளின் ஆரத்துடன் ஒப்பிடும்போது, கருவின் பரிமாணங்கள் மிகவும் சிறியவை: 10-15 - 10-14 மீ அனைத்து அணுக்களின் கருக்களும் புரோட்டான்கள் மற்றும் நியூட்ரான்களைக் கொண்டிருக்கின்றன, அவை கிட்டத்தட்ட ஒரே வெகுஜனத்தைக் கொண்டுள்ளன, ஆனால் புரோட்டான் மட்டுமே ஒரு பொருளைக் கொண்டுள்ளது. மின் கட்டணம். புரோட்டான்களின் மொத்த எண்ணிக்கை ஒரு அணுவின் அணு எண் Z என்று அழைக்கப்படுகிறது, இது நடுநிலை அணுவில் உள்ள எலக்ட்ரான்களின் எண்ணிக்கையைப் போன்றது. நியூக்ளியோன்கள் எனப்படும் அணு துகள்கள் (புரோட்டான்கள் மற்றும் நியூட்ரான்கள்), மிகவும் வலுவான சக்திகளால் ஒன்றாக இணைக்கப்படுகின்றன; அவற்றின் இயல்பின்படி, இந்த விசைகள் மின்சாரமாகவோ அல்லது ஈர்ப்பு விசையாகவோ இருக்க முடியாது, மேலும் அவை அணுக்கருவுடன் எலக்ட்ரான்களை பிணைக்கும் விசைகளை விட அதிக அளவு வரிசைகள் ஆகும். அணுக்கருவின் உண்மையான அளவைப் பற்றிய முதல் யோசனை, மெல்லிய உலோகத் தகடுகளில் ஆல்பா துகள்களை சிதறடிப்பது பற்றிய ரதர்ஃபோர்டின் சோதனைகளால் வழங்கப்பட்டது. துகள்கள் எலக்ட்ரான் ஓடுகள் வழியாக ஆழமாக ஊடுருவி, அவை சார்ஜ் செய்யப்பட்ட கருவை நெருங்கும்போது திசைதிருப்பப்பட்டன. இந்தச் சோதனைகள் மத்திய அணுக்கருவின் சிறிய அளவைத் தெளிவாகக் குறிப்பிட்டன மற்றும் அணுக்கரு மின்னூட்டத்தை நிர்ணயிப்பதற்கான ஒரு முறையைக் குறிப்பிட்டன. ஆல்பா துகள்கள் நேர்மறை மின்னூட்டத்தின் மையத்தை சுமார் 10-14 மீ தொலைவில் அணுகுவதை ரதர்ஃபோர்ட் கண்டறிந்தார், மேலும் இது அணுக்கருவின் அதிகபட்ச சாத்தியமான ஆரம் என்று முடிவு செய்ய அவரை அனுமதித்தது. இத்தகைய அனுமானங்களின் அடிப்படையில், போர் தனது அணுவின் குவாண்டம் கோட்பாட்டை உருவாக்கினார், இது தனித்துவமான நிறமாலை கோடுகள், ஒளிமின்னழுத்த விளைவு, எக்ஸ்-கதிர்கள் மற்றும் தனிமங்களின் கால அட்டவணையை வெற்றிகரமாக விளக்கியது. இருப்பினும், போரின் கோட்பாட்டில் கரு ஒரு நேர்மறை புள்ளி கட்டணமாக கருதப்பட்டது. பெரும்பாலான அணுக்களின் கருக்கள் மிகச் சிறியதாக மாறியது மட்டுமல்லாமல், வில் தீப்பொறி வெளியேற்றம், சுடர் போன்ற அற்புதமான ஆப்டிகல் நிகழ்வுகளால் அவை எந்த வகையிலும் பாதிக்கப்படவில்லை. 1896 ஆம் ஆண்டில் ஏ. பெக்கரெல் என்பவரால் கதிரியக்கத்தின் கண்டுபிடிப்பு கருவின் ஒரு குறிப்பிட்ட உள் அமைப்பு இருப்பதைக் குறிக்கிறது. யுரேனியம், பின்னர் ரேடியம், பொலோனியம், ரேடான் போன்றவை என்று மாறியது. குறுகிய-அலை மின்காந்த கதிர்வீச்சு, எக்ஸ்-கதிர்கள் மற்றும் எலக்ட்ரான்கள் (பீட்டா கதிர்கள்), ஆனால் கனமான துகள்கள் (ஆல்ஃபா கதிர்கள்) ஆகியவற்றை வெளியிடுகின்றன, மேலும் இவை அணுவின் பாரிய பகுதியிலிருந்து மட்டுமே வர முடியும். ரதர்ஃபோர்ட் தனது சிதறல் சோதனைகளில் ரேடியம் ஆல்பா துகள்களைப் பயன்படுத்தினார், இது அணு அணுவைப் பற்றிய கருத்துக்களை உருவாக்குவதற்கு அடிப்படையாக அமைந்தது. (அப்போது ஆல்பா துகள்கள் ஹீலியம் அணுக்கள் என்பது எலக்ட்ரான்களிலிருந்து அகற்றப்பட்டது; ஆனால் சில கனமான அணுக்கள் ஏன் தன்னிச்சையாக அவற்றை வெளியிடுகின்றன என்ற கேள்விக்கு இன்னும் பதிலளிக்கப்படவில்லை, அல்லது கருவின் அளவைப் பற்றிய துல்லியமான யோசனை இல்லை.)
கர்னல் மாதிரிகள்
ஆரம்பம் அணு இயற்பியலின் வளர்ச்சியின் காலம் அணுக்கருவின் நீர்த்துளிகள் மற்றும் ஷெல் மாதிரிகளின் உருவாக்கம் மற்றும் வளர்ச்சியுடன் தொடர்புடையது. இந்த யா 30 களில் கிட்டத்தட்ட ஒரே நேரத்தில் எழுந்தது. 20 ஆம் நூற்றாண்டு அவை பல்வேறு அடிப்படையிலானவை பிரதிநிதித்துவங்கள் மற்றும் கருக்களின் எதிர் பண்புகளை விவரிக்கும் நோக்கம் கொண்டது. துளி மாதிரியில், மையமானது நியூட்ரான் மற்றும் புரோட்டான் திரவங்களைக் கொண்ட தொடர்ச்சியான ஊடகமாகக் கருதப்படுகிறது மற்றும் கிளாசிக்கல் சமன்பாடுகளால் விவரிக்கப்படுகிறது. ஹைட்ரோடைனமிக்ஸ் (எனவே மற்றொரு பெயர் - ஹைட்ரோடைனமிக்ஸ்). அடர்த்தி அணு திரவமானது துளியின் அளவின் உள்ளே கிட்டத்தட்ட நிலையானது மற்றும் மேற்பரப்பு அடுக்கில் கூர்மையாக குறைகிறது, இதன் தடிமன் துளியின் ஆரம் விட கணிசமாகக் குறைவாக உள்ளது. அடிப்படை அளவுருக்கள்: எல்லையற்ற அணுக்கரு திரவத்தின் சமநிலை அடர்த்தி r 0 (0.16 துகள்கள்/fm 3), பிணைப்பு ஆற்றல் 1 நியூக்ளியோனுக்கு m 0 (16 MeV) மற்றும் குணகம். மேற்பரப்பு பதற்றம் s (1 MeV/fm 2); சில நேரங்களில் s 1 மற்றும் s 2 ஆகியவை நியூட்ரான்கள் மற்றும் புரோட்டான்களுக்கு தனித்தனியாக அறிமுகப்படுத்தப்படுகின்றன. நியூட்ரான் மிகுதியின் மதிப்பில் அணுக்கரு பிணைப்பு ஆற்றலின் சார்புநிலையை கணக்கில் கொள்ள ( N-Z; என்மற்றும் Z-முறையே, கருவில் உள்ள நியூட்ரான்கள் மற்றும் புரோட்டான்களின் எண்ணிக்கை), ஒரு ஐசோவெக்டர் குணகம் அறிமுகப்படுத்தப்பட்டது. அணுக்கருப் பொருளின் சுருக்கத்தன்மை b (30 MeV); அணுக்கரு பொருளின் வரையறுக்கப்பட்ட சுருக்கத்தன்மையை கணக்கில் எடுத்துக்கொள்ள - ஐசோஸ்கல் குணகம். சுருக்கத்தன்மை (சுருக்க மாடுலஸ்) கே(200 MeV).
கருவின் துளி மாதிரிஅடிப்படையை விவரிக்கிறது மேக்ரோஸ்கோபிக் கருக்களின் பண்புகள்: செறிவூட்டல் பண்பு, அதாவது கனமான அணுக்களின் பிணைப்பு ஆற்றலின் நிறை எண் A = N+Z க்கு விகிதாசாரம்; A இல் மைய ஆரம் R இன் சார்பு: R = r 0 A 1/3, இங்கு r 0 என்பது கிட்டத்தட்ட நிலையான குணகம். (1.06 fm) லேசான கருக்கள் தவிர. இது வெய்சாக்கர் சூத்திரத்திற்கு வழிவகுக்கிறது, இது சராசரியாக கருக்களின் பிணைப்பு ஆற்றல்களை நன்கு விவரிக்கிறது. துளி மாதிரியானது அணுக்கரு பிளவை நன்கு விவரிக்கிறது. என்று அழைக்கப்படும் இணைந்து. ஷெல் திருத்தம் (கீழே காண்க) இது இன்னும் அடிப்படையாக செயல்படுகிறது. இந்த செயல்முறையை ஆய்வு செய்வதற்கான கருவி.
கருவின் ஷெல் மாதிரியானது, ஒரு ஊடகத்தில் சுதந்திரமாக நகரும் நியூக்ளியோன்களின் அமைப்பாக அணுக்கருவின் கருத்தை அடிப்படையாகக் கொண்டது. மீதமுள்ள நியூக்ளியோன்களின் சக்தி நடவடிக்கையால் உருவாக்கப்பட்ட கருவின் புலம். இந்த அணுக்கரு மாதிரியானது ஷெல்களின் அணு மாதிரியுடன் ஒப்புமையாக உருவானது மற்றும் முதலில் வெய்சாக்கர் சூத்திரம் மற்றும் இருப்பு ஆகியவற்றில் இருந்து சோதனை ரீதியாக கண்டுபிடிக்கப்பட்ட விலகல்களை விளக்குவதற்கு நோக்கம் கொண்டது. மந்திரமான N மற்றும் Z மிகவும் ஒத்திருக்கும் கருக்கள். பிணைப்பு ஆற்றலின் உச்சரிக்கப்படுகிறது. துளி மாதிரியைப் போலல்லாமல், உடனடியாக அதன் முடிக்கப்பட்ட வடிவத்தில் தோன்றியது, ஷெல் மாதிரி நீண்ட கால வளர்ச்சிக்கு உட்பட்டது. தேடல் காலம் தேர்வு நேரம். சாத்தியமான வடிவங்கள் cf. புலம் U(r), மந்திரத்தின் சரியான மதிப்புகளை வழங்குகிறது. எண்கள். முடிவில் தீர்க்கமான நடவடிக்கை எடுக்கப்பட்டது. 40கள் M. Goeppert-Mayer மற்றும் H. Jensen, சுழல்-சுற்றுப்பாதை காலத்தின் (U SL) சராசரியின் முக்கிய பங்கைக் கண்டுபிடித்தனர். வயல்வெளிகள். மையத்திற்கு நவீன காலத்தில் மையத்தின் பகுதிகள். கோட்பாடுகள் பொதுவாக சாக்சன்-வூட்ஸ் திறனைப் பயன்படுத்துகின்றன.
அணுசக்தி எதிர்வினைகள்
அணுக்கரு எதிர்வினைகள், அடிப்படைத் துகள்கள், ஜி-குவாண்டா அல்லது ஒன்றோடொன்று தொடர்பு கொள்ளும்போது அணுக்கருக்களின் மாற்றங்கள். அணுக்கரு இயற்பியலில் அணுக்கரு வினைகள் பயன்படுத்தப்படுகின்றன.
POROGREACTIONS 
அணுசக்தி எதிர்வினைகளின் வழிமுறைகள்.
தொடர்பு பொறிமுறையின் படி, அணுக்கரு எதிர்வினைகள் இரண்டு முக்கிய வகைகளாக பிரிக்கப்படுகின்றன:
ஒரு கலவை அணுக்கரு உருவாவதற்கான எதிர்வினைகள் குறைந்த வெப்பநிலையில் நிகழும் இரண்டு-நிலை செயல்முறையாகும்.
மோதும் துகள்களின் உயர் இயக்க ஆற்றல் (தோராயமாக 10 MeV வரை).
துகள் தேவைப்படும் அணு நேரத்தில் நடக்கும் நேரடி அணுக்கரு எதிர்வினைகள்
மையத்தை கடந்தது. இந்த பொறிமுறையானது முக்கியமாக குண்டுவீச்சு துகள்களின் மிக உயர்ந்த ஆற்றல்களில் தன்னை வெளிப்படுத்துகிறது.
ஒளியியலின் போக்கில் இருந்து, ஒளியியல் நிகழ்வுகளின் முழுத் தொடரையும் அலைக் கண்ணோட்டத்தில் இருந்து தொடர்ந்து விவரிக்க முடியும் என்பது அறியப்படுகிறது; எடுத்துக்காட்டுகள் ஒளியின் குறுக்கீடு மற்றும் மாறுபாட்டின் நன்கு அறியப்பட்ட நிகழ்வுகளாகும். மறுபுறம் (முந்தைய பத்தியில் விவாதிக்கப்பட்ட காம்ப்டன் விளைவைப் பார்ப்போம்), ஒளியானது அதன் கார்பஸ்குலர் தன்மையை தெளிவாகக் காட்டுகிறது. இந்த அலை-துகள் இரட்டைவாதம் ஒரு சோதனை உண்மையாகக் கருதப்பட வேண்டும், எனவே ஒளியின் நிலையான கோட்பாடு அலை-துகள் கோட்பாடாக இருக்க வேண்டும். நிச்சயமாக, சில கட்டுப்படுத்தும் சந்தர்ப்பங்களில், அலை அல்லது உடல் விளக்கங்கள் மட்டுமே போதுமானதாக இருக்கலாம்.
அது மாறிவிடும், அதே நேரத்தில் பூஜ்ஜியமற்ற நிறை கொண்ட பொருளின் துகள்கள் (உதாரணமாக, எலக்ட்ரான்கள், புரோட்டான்கள், நியூட்ரான்கள், அணுக்கள், மூலக்கூறுகள் போன்றவை) அலை பண்புகளை வெளிப்படுத்துகின்றன என்பதை நாம் மீண்டும் பரிசோதனைக்கு உட்படுத்துவோம். எனவே அவற்றுக்கும் ஃபோட்டான்களுக்கும் இடையே அடிப்படை வேறுபாடு இல்லை.
இந்த கட்டத்தில், மேக்ரோவிலிருந்து மைக்ரோ பொருள்களுக்கு நகரும் போது, உடல் நிகழ்வுகளின் சாரத்தை புரிந்துகொள்வதில் ஒரு குறிப்பிட்ட சிரமம் எழுகிறது. உண்மையில், மேக்ரோபினோமினா மட்டத்தில், கார்பஸ்குலர் மற்றும் அலை விளக்கங்கள் தெளிவாக வேறுபடுகின்றன. நுண்ணிய நிகழ்வுகளின் மட்டத்தில், இந்த எல்லை பெரும்பாலும் மங்கலாகிறது மற்றும் ஒரு நுண்ணிய பொருளின் இயக்கம் அலை மற்றும் கார்பஸ்குலர் ஆகிய இரண்டாக மாறும். வேறு வார்த்தைகளில் கூறுவதானால், ஒரு நுண்பொருள் ஓரளவிற்கு கார்பஸ்கிளுக்கு ஒத்ததாகவும், ஓரளவிற்கு அலைக்கு ஒத்ததாகவும் இருக்கும் சூழ்நிலை யதார்த்தத்திற்கு மிகவும் போதுமானதாகிறது, மேலும் இந்த அளவு நுண்ணிய பொருளைக் கவனிக்கும் உடல் நிலைகளைப் பொறுத்தது.
அனைத்து நுண் துகள்களின் இந்த அம்சத்தை கணக்கில் எடுத்துக் கொள்ளும் ஒரு நிலையான கோட்பாடு குவாண்டம் கோட்பாடு ஆகும். ஆனால் அதன் முக்கிய யோசனைகளை வழங்குவதற்கு முன், ஒரே இயற்பியல் பொருள், கொள்கையளவில், கார்பஸ்குலர் அல்லது அலை பண்புகளை எவ்வாறு வெளிப்படுத்த முடியும் மற்றும் இந்த இரண்டு வெவ்வேறு விளக்க முறைகளுக்கு இடையே என்ன ஒப்பீடு உள்ளது என்பதை நிறுவுவது அவசியம்.
ஒளியியல் நிகழ்வுகளில், ஒரு கதிர் (அதாவது, கார்பஸ்குலர் படம்) என்ற கருத்தின் பொருந்தக்கூடிய அளவுகோல் நிறுவப்பட்டது மற்றும் அலை கருத்துகளிலிருந்து கார்பஸ்குலர்களுக்கு மாறுவதற்கான விதிகள் கண்டறியப்பட்டுள்ளன. இந்த திசையில் தொடர்ந்து பகுத்தறிந்து, ஒருவர் நம்பலாம்! இங்கே எதிர் திசையில் மாற்றம் உள்ளது: கிளாசிக்கல் மெக்கானிக்ஸின் கார்பஸ்குலர் கருத்துகளிலிருந்து குவாண்டம் இயக்கவியலின் அலை கருத்துகள் வரை.
ஆப்டிகல்-மெக்கானிக்கல் ஒப்புமையைப் பயன்படுத்தி தொடர்புடைய கருத்துக்கள் 1924 இல் பிரெஞ்சு இயற்பியலாளர் எல். டி ப்ரோக்லியால் வெளிப்படுத்தப்பட்டன. டி ப்ரோக்லி, அலை-துகள் இருமை என்பது ஆப்டிகல் நிகழ்வுகளின் தனித்தன்மை அல்ல, ஆனால் உலகளாவிய பொருந்தக்கூடிய தன்மையைக் கொண்ட ஒரு தைரியமான கருதுகோளை முன்வைத்தார். நுண்ணுலகின் இயற்பியல் முழுவதும். "இயற்பியலில் புரட்சி" என்ற புத்தகத்தில் அவர் எழுதினார்: "ஒரு நூற்றாண்டு காலமாக ஒளியியலில், அலை முறையுடன் ஒப்பிடுகையில் கார்பஸ்குலர் முறை மிகவும் புறக்கணிக்கப்பட்டது; பொருளின் கோட்பாட்டில் எதிர் பிழை செய்யப்படவில்லையா? நாம் அதிகம் சிந்திக்கவில்லையா? "துகள்கள்" மற்றும் புறக்கணிக்கப்பட்ட படம் பற்றி இது அலைகளின் படமா?"
பின்வரும் பரிசீலனைகள் அவரை பொருள் துகள்களில் அலை பண்புகளை அனுமானிக்க வழிவகுத்தது. XIX நூற்றாண்டின் 20 களின் இறுதியில். வி. ஹாமில்டன், வடிவியல் ஒளியியல் மற்றும் கிளாசிக்கல் (நியூட்டோனியன்) இயக்கவியலுக்கு இடையே உள்ள அற்புதமான ஒப்புமைக்கு கவனத்தை ஈர்த்தார். முதல் பார்வையில் மிகவும் வேறுபட்ட இயற்பியலின் இந்த கிளைகளின் அடிப்படை விதிகள் கணித ரீதியாக ஒரே மாதிரியான வடிவத்தில் குறிப்பிடப்படலாம் என்று காட்டப்பட்டது. இதன் விளைவாக, சாத்தியமான ஆற்றலுடன் ஒரு வெளிப்புற புலத்தில் ஒரு துகள்களின் இயக்கத்தைக் கருத்தில் கொள்வதற்குப் பதிலாக, சரியான முறையில் தேர்ந்தெடுக்கப்பட்ட ஒளிவிலகல் குறியீட்டுடன் ஒரு ஒளியியல் ஒத்திசைவற்ற ஊடகத்தில் ஒரு ஒளி கற்றையின் பரவலைப் படிக்கலாம். நிச்சயமாக, விளக்கங்களின் இந்த சமன்பாடு ஒரு தலைகீழ் மாற்றத்தையும் அனுமதிக்கிறது.
குறிப்பிடப்பட்ட ஒப்புமை ஹாமில்டனால் வடிவியல் ஒளியியல் மற்றும் கிளாசிக்கல் இயக்கவியலுக்கு மட்டுமே நீட்டிக்கப்பட்டது. ஆனால், ஏற்கனவே குறிப்பிட்டுள்ளபடி, வடிவியல் ஒளியியல் என்பது மிகவும் பொதுவான அலை ஒளியியலின் தோராயமாகும் மற்றும் ஒளியின் முற்றிலும் அலை பண்புகளை விவரிக்கவில்லை. இதையொட்டி, கிளாசிக்கல் மெக்கானிக்ஸ் வரையறுக்கப்பட்ட அளவிலான பொருந்தக்கூடிய தன்மையைக் கொண்டுள்ளது: அறியப்பட்டபடி, அணு அமைப்புகளில் தனித்துவமான ஆற்றல் நிலைகள் இருப்பதை விளக்க முடியாது.
டி ப்ரோக்லியின் யோசனையானது ஒளியியல் மற்றும் இயக்கவியலுக்கு இடையே உள்ள ஒப்புமையை விரிவுபடுத்துவது மற்றும் அலை இயக்கவியலை அலை ஒளியியலுடன் ஒப்பிடுவது, பிந்தையதை உள்-அணு நிகழ்வுகளுக்குப் பயன்படுத்த முயற்சித்தது. "எலக்ட்ரானுக்கும், பொதுவாக அனைத்து துகள்களுக்கும், ஃபோட்டான்கள், இரட்டை இயல்பு, ஒரு அளவு நடவடிக்கை (பிளாங்கின் மாறிலி) மூலம் ஒன்றோடொன்று இணைக்கப்பட்ட அலை கார்பஸ்குலர் பண்புகளை வழங்குவதற்கான ஒரு முயற்சி - அத்தகைய பணி மிகவும் அவசியமானதாகவும் பயனுள்ளதாகவும் தோன்றியது. .. அலை இயல்பின் புதிய இயக்கவியலை உருவாக்குவது அவசியம், இது பழைய இயக்கவியலை அலை ஒளியியல் என்பது வடிவியல் ஒளியியலாகக் கருதும்" என்று டி ப்ரோக்லி "இயற்பியலில் புரட்சி" என்ற புத்தகத்தில் எழுதினார்.
பொருளின் அலை பண்புகளை கண்டுபிடித்ததற்காக, எல். டி ப்ரோக்லிக்கு 1929 இல் நோபல் பரிசு வழங்கப்பட்டது.
இப்போது பிரச்சினையின் முறையான பக்கத்திற்கு வருவோம். நிறை கொண்ட ஒரு நுண் துகள் (உதாரணமாக, எலக்ட்ரான்) இருக்க வேண்டும் எம்நிலையான வேகத்தில் வெற்றிடத்தில் நகரும். கார்பஸ்குலர் விளக்கத்தைப் பயன்படுத்தி, துகளுக்கு ஆற்றலைக் கூறுகிறோம் ஈமற்றும் சூத்திரங்களுக்கு ஏற்ப உந்தம் (ஒரு சார்பியல் துகள்களின் பொது வழக்கைக் கவனியுங்கள்).
 . (1.2.1)
. (1.2.1)
மறுபுறம், அலை படத்தில் நாம் அதிர்வெண் மற்றும் அலைநீளம் (அல்லது அலைஎண்) கருத்துகளைப் பயன்படுத்துகிறோம். இரண்டு விளக்கங்களும் ஒரே இயற்பியல் பொருளின் வெவ்வேறு அம்சங்களாக இருந்தால், அவற்றுக்கிடையே ஒரு தெளிவற்ற உறவு இருக்க வேண்டும். டி ப்ரோக்லியைப் பின்பற்றி, ஒரு படத்திலிருந்து மற்றொரு படத்திற்கு மாறுவதற்கான அதே விதிகளை பொருளின் துகள்களின் விஷயத்திற்கு மாற்றுவோம், அவை ஒளியில் பயன்படுத்தப்படும்போது செல்லுபடியாகும்:
![]() (1.2.2)
(1.2.2)
உறவுகள் (1.2.2) என்று அழைக்கப்படுகின்றன டி ப்ரோக்லி சூத்திரம். துகள் தொடர்புடைய அலைநீளம் மூலம் வழங்கப்படுகிறது
![]() (1.2.3)
(1.2.3)
அவர்கள் அவளை அழைக்கிறார்கள் டி ப்ரோக்லி அலைநீளம். ஒளியுடனான ஒப்புமை மூலம், துல்லியமாக இந்த அலைநீளம் தான் அலை அல்லது கார்பஸ்குலர் படங்களின் பொருந்தக்கூடிய அளவுகோல்களில் தோன்ற வேண்டும் என்பதை புரிந்துகொள்வது கடினம் அல்ல.
ஒரு குறிப்பிட்ட அதிர்வெண் மற்றும் அலை திசையன் கொண்ட வெற்றிடத்தில் உள்ள எளிய வகை அலை ஒரு விமான ஒற்றை நிற அலை ஆகும்.
10 - 20 களில் தொடர்ச்சியான சோதனைகள் மேற்கொள்ளப்பட்டன. XX நூற்றாண்டு, பொதுவாக "பிரபஞ்சத்தின் கட்டுமானத் தொகுதிகள்" என்று கருதப்படும் துகள்கள், திடமான பந்துகள் - கார்பஸ்கிள்கள், அலை பண்புகளை வெளிப்படுத்துகின்றன. ஒரு படிகத்தின் மீது எலக்ட்ரான் மாறுபாடு நிரூபிக்கப்பட்டுள்ளது, அதாவது. எலக்ட்ரான் கற்றை ஒரு மின்காந்த அலையைப் போலவே செயல்படுகிறது. 1924 ஆம் ஆண்டில், லூயிஸ் டி ப்ரோக்லி அனைத்து துகள்களும் (எனவே இந்த துகள்களைக் கொண்ட அனைத்து உடல்களும்) அலை பண்புகளைக் கொண்டிருப்பதாக அனுமானித்தார். இந்த அலை பண்புகளின் அளவீடு அழைக்கப்படுகிறது டி ப்ரோக்லி அலைநீளம் . உண்மையில், ஒரு குவாண்டம் (ஃபோட்டான்) அதிர்வெண் n மற்றும் அலைநீளம் l = c/n மற்றும் ஒரு எலக்ட்ரானை உந்தத்துடன் ஒப்பிடுவோம். р = m e v:
![]() .
.
சாதாரண உடல்களுக்கான l B இன் மதிப்பு மிகவும் சிறியது, மேலும் அவற்றின் அலை பண்புகளை கவனிக்க முடியாது (நினைவில் கொள்ளுங்கள்: மாறுபாட்டிற்கு பொருளின் அளவு l இன் வரிசையில் இருக்க வேண்டும்). அதனால்தான் எலக்ட்ரான் போன்ற ஒளித் துகள்களின் அலை பண்புகள் சோதனையில் தோன்றும். அலை பண்புகள் நிரூபிக்கப்பட்ட மிகப்பெரிய பொருள்கள் ஃபுல்லெரின் மூலக்கூறுகள் C 60 மற்றும் C 70 (நிறை ~ 10 -24 கிலோ).
எனவே , நமது காலத்தின் மிக முக்கியமான கருத்துக்களில் ஒன்று, அனைத்து வகையான பொருள், பொருள் மற்றும் புலத்தின் ஒற்றுமை பற்றிய யோசனையாகும். அவற்றுக்கிடையே எந்த அடிப்படை வேறுபாடுகளும் இல்லை, பொருள் ஒரு பொருளாகவும் புலமாகவும் வெளிப்படும். இந்த கருத்து அழைக்கப்படுகிறது பொருளின் துகள்-அலை இரட்டைவாதம் (இருமை)..
அதே நேரத்தில், கிளாசிக்கல் அறிவியலின் அடிப்படையில் கவனிக்கக்கூடிய அனைத்து அளவுகளையும் வகைப்படுத்த வேண்டிய கட்டாயத்தில் இருக்கிறோம், அதாவது. நாம் இருக்கும் மேக்ரோகோஸ்ம் மட்டத்தில். ஒரு துகள் மற்றும் அலை ஆகிய இரண்டையும் கொண்ட ஒரு பொருளை நாம் கற்பனை செய்வது கடினம், ஏனென்றால் அன்றாட வாழ்க்கையில் இதுபோன்ற பொருட்களை நாம் சந்திப்பதில்லை. முறையான நோக்கங்களுக்காக இந்த கருத்துகளை பிரிக்க வேண்டியது அவசியம். சிந்தனை மனிதர்களாகிய நமது கட்டமைப்பின் சிக்கலான தன்மையில் காரணங்கள் உள்ளன. சைபர்நெடிக்ஸ் அறிவியல், சுய-இனப்பெருக்கம் செய்யும் அமைப்பு அதிக சிக்கலான தன்மையைக் கொண்டிருக்க வேண்டும் என்பதைக் காட்டுகிறது. நுண்ணிய உலகத்தை வெளியில் இருந்து படிப்பது போல, அதன் பொருள்களை விட கட்டமைப்பில் மிகவும் சிக்கலானதாக இருக்கிறோம். துல்லியமாகவும் இந்த காரணத்திற்காகவும் மட்டுமே பொருளின் இரட்டைத்தன்மை அதன் வெளிப்படையான, இயற்கையான, உள்ளார்ந்த சொத்தாக நமக்குத் தெரியவில்லை.
3. நுண் துகள்களின் இயக்கவியல். ஹைசன்பெர்க் நிச்சயமற்ற கொள்கை
ஒரு துகள் அலையின் பண்புகளை வெளிப்படுத்தினால், அது விண்வெளியில் மங்கலாக இருப்பது போல், அலை பாக்கெட்டைக் குறிக்கும். இந்த வழக்கில், அதன் ஆயங்களைப் பற்றி பேச முடியாது. ஆனால், எடுத்துக்காட்டாக, அலைப் பொதியின் தொடக்கத்தையோ அல்லது அதன் உறையின் அதிகபட்ச ஒருங்கிணைப்பையோ எடுத்துக் கொள்ள முடியாதா?
நுண் துகள்களின் ஆயங்களின் நிச்சயமற்ற தன்மை நுண்ணுலகின் அடிப்படைச் சொத்து என்பதும், நுண் துகள்களின் வேகத்தையும் துல்லியமாக அளவிட முடியாது. இந்த உண்மைக்கும் அளவீட்டு கருவிகளின் துல்லியத்திற்கும் எந்த தொடர்பும் இல்லை.
உண்மையில், நாம் ஒரு துகளின் நிலை மற்றும் வேகத்தை அளவிட முயற்சிக்கிறோம் என்று கற்பனை செய்து பாருங்கள், இதற்காக ஒளியைப் பயன்படுத்துகிறோம். நாம் அளவிடக்கூடிய குறைந்தபட்ச தூரம் இந்த ஒளியின் அலைநீளத்தால் தீர்மானிக்கப்படும், மேலும் அது குறைவாக இருந்தால், அளவீடு மிகவும் துல்லியமாக இருக்கும். ஆனால் ஒளியின் அலைநீளம் குறைவாக இருப்பதால், அதன் அதிர்வெண் அதிகமாகும் மற்றும் குவாண்டத்தின் ஆற்றல் அதிகமாகும். அதிக ஆற்றல் கொண்ட ஒரு குவாண்டம், ஆய்வின் கீழ் உள்ள துகளுடன் தொடர்பு கொண்டு அதன் ஆற்றலின் ஒரு பகுதியை அதற்கு மாற்றும். நாம் இறுதியில் அளவிடும் வேகமானது துகள்களின் விரும்பிய ஆரம்ப வேகமாக இருக்காது, ஆனால் அளவிடும் சாதனத்துடன் அதன் தொடர்புகளின் விளைவாகும். எனவே, நாம் ஒருங்கிணைப்பை எவ்வளவு துல்லியமாக அளவிடுகிறோமோ, அவ்வளவு துல்லியமான வேக அளவீடு மற்றும் நேர்மாறாகவும் இருக்கும்.
அலைக்காக x p = l E/c = l hn/c =l h/l = h- இது அதிகபட்ச துல்லியம்.
ஒரு ஒருங்கிணைப்பைக் கண்டுபிடிப்பதில் உள்ள நிச்சயமற்ற தன்மைகளுக்கு இடையிலான உறவை வெளிப்படுத்தும் சூத்திரம் எக்ஸ்மற்றும் வேகம் ஆர்துகள்கள், முதலில் டபிள்யூ. ஹைசன்பெர்க் என்பவரால் பெறப்பட்டது மற்றும் அவரது பெயரைக் கொண்டுள்ளது:
Dх Dr ³ h -
- ஹைசன்பெர்க் நிச்சயமற்ற கொள்கை.
Dу மற்றும் Dz போன்ற நிச்சயமற்ற உறவுகள் உள்ளன.
ஆற்றல் மற்றும் நேர நிச்சயமற்ற தன்மைக்கு நாம் பெறுவது:
எனவே, நிச்சயமற்ற கொள்கை என்பது இயற்கையின் அடிப்படைச் சொத்து, எந்த வகையிலும் அளவிடும் கருவிகளின் அபூரணத்துடன் தொடர்புடையது, ஆனால் ஒரு அடிப்படை இயல்பு.
நிச்சயமற்ற கொள்கை, குவாண்டா என்ற கருத்துடன் சேர்ந்து, புதிய குவாண்டம் இயக்கவியலின் அடிப்படையை உருவாக்கியது, அதன் கருத்துக்கள் மற்றும் சிக்கல்களின் வரம்புகள் விஞ்ஞானத்திற்கு முன்னர் அறியப்பட்ட எல்லாவற்றிலிருந்தும் வேறுபட்ட வகையில் புரட்சிகரமானவை. விஞ்ஞான முன்னுதாரணம் உடைக்கப்பட்டது, மைக்ரோவேர்ல்டின் நிகழ்வுகளைக் கருத்தில் கொள்வதற்கான அடிப்படையில் ஒரு புதிய அணுகுமுறை எழுந்தது, இது பின்னர் அறிவியலின் பிற பகுதிகளில் மிகவும் பயனுள்ளதாக மாறியது.